Chương 2-Các kỹ thuật xử lý mẫu phân tích
2.1. Yêu cầu chung của kỹ thuật xử lý mẫu
2.1.1. Yêu cầu chung của kỹ thuật xử lý mẫu phân tích
2.1.2. Vấn đề QA/QC trong xử lý mẫu phân tích
2.1.2.1 Khái niệm về QA
2.1.2.2. Khái niệm về QC
2.1.2.3. Nội dung và quan hệ QA/QC trong xử lý mẫu
2.2. Phân loại mẫu phân tích
2.2.1. Phân loại theo hóa học phân tích
2.2.2. Phân loại theo trạng thái tồn tại
2.2.3. Phân loại theo nhóm ngành
2.3. Trang bị để xử lý mẫu phân tích
2.3.1. Yêu cầu của trang bị và điều kiện để xử lý mẫu
2.3.2. Các loại dụng cụ đơn giản
2.3.3. Các loại trang bị hoàn chỉnh
2.4. Khái quát về bản chất các kỹ thuật xử lý mẫu
2.4.1. Kỹ thuật vô cơ hóa ướt (xử lý ướt)
2.4.1.1. Bằng acid mạnh, đặc và có tính oxy hóa
2.4.1.2. Xử lý mẫu bằng dung dịch kiềm mạnh đặc nóng.
2.4.1.3. Xử lý ướt trong lò vi sóng
2.4.2. Kỹ thuật vô cơ hóa khô (xử lý khô)
2.4.2.1. Nguyên tắc và quá trình xảy ra trong xử lý
2.4.2.2. Trang bị để xử lý mẫu khô
2.4.2.3. Tro hóa không không có phụ gia bảo vệ và chất chảy
2.4.2.4. Tro hóa có phụ gia và chất chảy bảo vệ
2.4.2.5. Ưu nhược điểm và phạm vi sử dụng
2.4.3. Kỹ thuật vơ cơ hóa tro-ướt kết hợp
2.4.3.1. Nguyên tắc chung
2.4.3.2. Các phương pháp và ví dụ
2.4.3.3. Ưu nhược điểm và phạm vi áp dụng
2.4.4. Các kỹ thuật chiết
2.4.4.1. Cơ sở, nguyên tắc và điều kiện của sự chiết
2.4.4.2. Các phương pháp và kỹ thuật chiết
2.4.4.2.1. Phương pháp chiết lỏng-lỏng
2.4.4.2.2. Kỹ thuật chiết Soxhlet.
2.4.4.2.3. Kỹ thuật chiết siêu âm
2.4.4.2.4. Kỹ thuật chiết pha rắn.
2.4.4.5. Kỹ thuật chiết bẫy hấp phụ dạng khí (chiết rắn-khí)
2.4.4.5.1. Nguyên tắc chung
2.4.4.5.2. Các kiểu chiết, trang thiết bị và ví dụ
2.4.5. Kỹ thuật chưng cất
2.4.5.1. Nguyên tắc chung
2.4.5.2. Các kiểu và phương pháp chưng cất
2.4.5.2. Các kiểu và phương pháp chưng cất
2.4.5.2.1. Chưng cất thông thường
2.4.5.2.2. Chưng cất lôi cuốn hơi nuớc.
2.4.5.2.3. Chưng cất ở áp suất thấp- cô quay chân không
2.4.6. Kỹ thuật lên men mẫu
2.4.7. Phương pháp pha loãng bằng dung môi thích hợp.
2.4.8. Kỹ thuật thăng hoa lấy mẫu phân tích.
2.4.9. Kỹ thuật chlor hóa mẫu.
2.4.10. Kết tủa hay hóa lỏng ở nhiệt độ thấp
2.4.11. Kỹ thuật điện phân
2.4.12. Các phương pháp sắc ký
------------------------------------------------------------------------------------------------
2.1. Yêu cầu chung của kỹ thuật xử lý mẫu
2.1.1. Yêu cầu chung của kỹ thuật xử lý mẫu phân tích
Xử lý mẫu là giai đoạn đầu tiên nhưng rất quan trọng của quá trình phân tích. Mọi sai sót trong giai đoạn này đều là nguyên nhân tạo ra sai số cho kết quả phân tích, có khi sai số rất lớn.Vì thế mọi cách xử lý mẫu để phân tích, cùng với việc tuân thủ theo QA/QC, còn phải bảo đảm được các yêu cầu cụ thể sau:
Xử lý mẫu là giai đoạn đầu tiên nhưng rất quan trọng của quá trình phân tích. Mọi sai sót trong giai đoạn này đều là nguyên nhân tạo ra sai số cho kết quả phân tích, có khi sai số rất lớn.Vì thế mọi cách xử lý mẫu để phân tích, cùng với việc tuân thủ theo QA/QC, còn phải bảo đảm được các yêu cầu cụ thể sau:
- Lấy được hoàn toàn, không làm mất chất phân tích
+ Không làm nhiễm bẩn thêm chất phân tích vào mẫu từ bất kỳ nguồn nào
+ Kết quả xử lý phải phù hợp với phương pháp phân tích đã chọn
- Dùng các hóa chất phải đảm bảo độ sạch đúng yêu cầu, mục đích và mức độ phân tích
- Không đưa thêm các chất có ảnh hưởng vào mẫu
- Có thể tách hay làm giàu được chất phân tích càng tốt
2.1.2. Vấn đề QA/QC trong xử lý mẫu phân tích
Mục tiêu chung của QA/QC trong xử lý mẫu phân tích là cung cấp hay đảm bảo đủ các điều kiện, các biện pháp tối thiểu cần thiết để đảm bảo xử lý được tốt mẫu phân tích đạt đúng chất lượng mong muốn.
Xử lý mẫu là khâu thứ hai và rất quan trọng của quá trình phân tích. Nếu việc xử lý mẫu không đảm bảo được độ trung thực, đúng đắn và loại được mọi sai sót ảnh hưởng như mất hay nhiễm bẩn chất phân tích thì các công việc sau đó dù cho có làm cẩn thận và chính xác đến đâu đi nữa thì số liệu phân tích cũng không cho ta đúng thực tế của chất phân tích có trong mẫu. Vì vậy để đảm bảo cho công việc xử lý mẫu được tốt thì nhất thiết phải thực hiện công tác QA/QC. Vậy QA/QC trong xử lý mẫu phân tích là gì?
2.1.2.1 Khái niệm về QA
Như chúng ta đã biết, mục tiêu chung của QA là cung cấp hay đảm bảo các điều kiện và biện pháp tối thiểu cần thiết để có được một sản phẩm của lĩnh vực nghiên cứu hay sản xuất đạt đúng chất lượng mong muốn. Do đó có thể nói một cách tóm tắt là trong công tác xử lý mẫu phân tích thì QA là các quy tắc, biện pháp và các điều kiện cần thiết đã được nghiên cứu, lựa chọn và biên soạn thành một quy trình (hệ thống), để phục vụ cho công tác xử lý mẫu phân tích nhằm mục đích lấy được dung dịch mẫu phân tích trung thực, không mất chất phân tích, không bị nhiễm bẩn và đại diện đúng cho đối tượng cần phân tích. Vì vậy thực hiện QA trong xử lý mẫu phân tích là điều rất cần thiết và chỉ có đảm bảo được QA trong xử lý mẫu thì chúng ta mới có đầy đủ điều kiện để khẳng định các số liệu phân tích là có cơ sở khoa học, đúng đắn và phản ánh đúng thành phần của chất phân tích có trong mẫu nghiên cứu.
2.1.2.2. Khái niệm về QC
Mục tiêu chung của QC là cung cấp các điều kiện và biện pháp kỹ thuật cần thiết để giám sát và kiểm soát chất lượng của một quá trình nào đó trong sản xuất hay nghiên cứu khoa học để đảm bảo chất lượng cho sản phẩm, đồng thời phát hiện các sai sót và tìm biện pháp khắc phục các sai sót để đảm bảo thu được sản phẩm có chất lượng đúng yêu cầu mong muốn. Vì thế trong công việc xử lý mẫu cùng với QA, cũng còn phải thực hiện cả biện pháp QC. Vậy QC
Trong công tác xử lý mẫu phân tích, QC là biện pháp, các điều kiện kỹ thuật và hoạt động giám sát và kiểm soát chất lượng của mọi công việc trong xử lý mẫu phân tích. Nó là các quy tắc, biện pháp và các điều kiện kỹ thuật đã được lựa chọn, xây dựng, biên soạn thành những quy trình để phục vụ việc kiểm tra, giám sát, kiểm chuẩn quá trình xử lý mẫu nhằm đảm bảo cho việc xử lý mẫu phân tích có được tính chính xác, đúng đắn và dung dịch mẫu thu được sau xử lý phản ánh và đại diện đúng cho đối tượng cần nghiên cứu phân tích. Đồng thời tránh hay hạn chế tối đa được các sai sót về trang bị, dụng cụ, hóa chất, sự nhiễm bẩn hay mất mát chất phân tích khi tiến hành xử lý mẫu và các tác động khác của môi trường làm việc mà chúng ta không mong muốn.Vì thế bắt buộc phải thực hiện các mẫu QC (như mẫu trắng hiện trường, mẫu trắng trang thiết bị, mẫu trắng phương pháp, mẫu thêm chuẩn, mẫu chuẩn thẩm định…).
2.1.2.3. Nội dung và quan hệ QA/QC trong xử lý mẫu
Xử lý mẫu là một hoạt động được thực hiện ở cả hiện trường và trong phòng thí nghiệm mà chủ yếu là trong phòng thí nghiệm. Nó là bước hoạt động thứ hai của toàn bộ dây chuyền hay công tác phân tích mẫu để có được số liệu, thông tin tin cậy về các đối tượng cần quan sát. Vì thế mọi sai sót trong xử lý mẫu đều ảnh hưởng đến kết quả phân tích. Do đó chúng ta phải quan tâm đúng mức đến việc bảo đảm chất lượng cho công tác hay mọi hoạt động xử lý mẫu phân tích để có được những lựa chọn về trang thiết bị, phương pháp, các điều kiện cần thiết về cách xử lý mẫu. Đó chính là nội dung của QA/QC trong xử lý mẫu phân tích. Về vấn đề này cần có một số quyết định cụ thể để thực hiện theo các nội dung chính sau đây:
- Nhân sự: xem xét tay nghề và khả năng của cán bộ phân tích
- Lựa chọn phương pháp để xử lý mẫu cho đối tượng cần phân tích
- Xác định khối lượng mẫu cần lấy để xử lý và số lượng cần xử lý kép
- Chọn trang thiết bị, dụng cụ và các điều kiện cần thiết để xử lý mẫu
- Lựa chọn cách kiểm tra phương pháp ứng dụng để xử lý
- Lựa chọn các hóa chất và thuốc thử cần thiết cho xử lý đạt yêu cầu
- Kiểm tra môi trường xung quanh trong quá trình xử lý mẫu
- Công tác kiểm chuẩn trong xử lý mẫu, mẫu lặp và mẫu trắng các loại …
- Chọn phương pháp bảo quản mẫu thu được sau khi đã xử lý để phân tích, nếu chưa tiến hành phân tích ngay được
Đồng thời theo các nội dung đã nêu trên thì hoạt động QA/QC trong công tác xử lý mẫu phân tích phải bao gồm các vấn đề sau đây, bắt đầu từ lúc chuẩn bị cho công tác xử lý mẫu phân tích cho đến khi thu được kết quả của chúng và bảo quản, nghĩa là phải thực hiện công tác QA/QC
- Đối với tất cả những người thực hiện xử lý mẫu phân tích
- Đối với các trang bị, máy móc và dụng cụ dùng để xử lý mẫu
- Đối với các chất chuẩn, hóa chất và thuốc thử cần dùng cho xử lý mẫu
- Đối với các loại dụng cụ đựng, chứa mẫu thu được sau xử lý
- Đối với các hoạt động trong khi tiến hành xử lý và ghi chép hồ sơ xử lý
- Đối với công tác kiểm chuẩn trong quá trình xử lý mẫu
- Đối với công tác bảo quản và lưu mẫu để phân tích
- Đối với việc phát hiện sai sót và các biện pháp khắc phục sai sót
Đó là các vấn đề đặt ra cho người làm phân tích trong giai đoạn xử lý mẫu. Làm tốt tất cả các vấn đề này tức là chúng ta đã thực hiện được QA/QC và hoạt động xử lý mẫu là thỏa mãn được các yêu cầu của phân tích. Nghĩa là trong mọi hoạt động của công tác xử lý mẫu phân tích từ lúc bắt đầu chuẩn bị cho đến lúc đã xử lý xong lấy được dung dịch mẫu và bảo quản chúng để phân tích theo một phương pháp đã được lựa chọn.
2.2. Phân loại mẫu phân tích
2.2.1. Phân loại theo hóa học phân tích
Theo quan điểm hóa học phân tích, người ta thường chia các loại mẫu phân tích thành hai nhóm chính, dựa trên thành phần nền (matrix) của mẫu là vô cơ hay hữu cơ
- Nhóm các loại mẫu có chất nền vô cơ
- Nhóm các loại mẫu có chất nền hữu cơ
Trong mỗi nhóm có thể phải xác định (phân tích) cả chất hữu cơ và vô cơ, tùy từng trường hợp và theo các yêu cầu phân tích cụ thể khác nhau.
2.2.2. Phân loại theo trạng thái tồn tại
Xét về mặt trạng thái của đối tượng mẫu phân tích thì lại có cách phân chia sau:
- các mẫu thuộc trạng thái khí: không khí, bụi, các chất khí …
- Các mẫu thuộc trạng thái rắn và bán rắn: sắt thép, kim loại, đất đá, quặng, bùn, cây, quả hạt các loại, thuốc dạng bột, viên…
- Các mẫu thuộc trạng thái lỏng như các loại nước tự nhiên, ao hồ, sông suối, nước sinh hoạt, nước giải khát, bia, rượu, xăng dầu…
Việc phân chia theo cách này, chúng ta thấy chỉ một loại cũng chứa nhiều thứ mẫu khác nhau về tính chất, vô cơ, hữu cơ lẫn lộn… Vì thế phân loại này có thể rất không khoa học và khó xem xét khi cần chọn các phương pháp xử lý mẫu để phân tích các chất cần thiết.
2.2.3. Phân loại theo nhóm ngành
- Mẫu nông nghiệp:
+ Các cây cối, thảo mộc
+ Các loại hoa quả, rau củ, sản phẩm nông nghiệp tươi sống
+ Các loại phân bón, đất trồng trọt
- Mẫu công nghiệp
+ Mẫu công nghiệp than và điện
+ Mẫu công nghiệp hóa chất
+ Mẫu công nghiệp dầu khí và tổng hợp hữu cơ
+ Mẫu công nghiệp thực phẩm…
- Mẫu dân dụng và sinh hoạt
+ Các loại mẫu sinh hoạt hằng ngày của người và động vật tạo ra
+ Các loại mẫu bệnh viện
- Các loại mẫu tự nhiên nư khoáng, quặng, đất đá…
Các phân loại này khi mới nhìn tưởng là chi tiết nhưng khi xem xét về cách xử lý mẫu thì mới thấy nhiều điều không hay. Do đó theo quan điểm của hóa phân tích thì cách đầu tiên là tương đối đơn giản và thích hợp nhất.
2.3. Trang bị để xử lý mẫu phân tích
2.3.1. Yêu cầu của trang bị và điều kiện để xử lý mẫu
Để xử lý mẫu tùy điều kiện về phân loại mẫu, về chất phân tích mà có sự lựa chọn các trang bị và phương pháp xử lý mẫu cho phù hợp. Ngày nay trên thị trường có nhiều loại trang thiết bị khác nhau dùng cho xử lý mẫu từ đơn giản đến phức tạp và hoàn toàn tự động. Song bất kỳ loại thiết bị nào cũng phải đảm bảo các vấn đề sau:
- Thực hiện QA/QC trong xử lý mẫu
- Cần chú ý thêm các yêu cầu cụ thể tối thiểu là:
+ Theo yêu cầu của mức độ phân tích và cấp hàm lượng
+ Phù hợp với mỗi loại mẫu, nếu đơn giản, phổ thông thì càng hay
+ Không làm mất và không làm nhiễm bẩn cho mẫu phân tích
2.3.2. Các loại dụng cụ đơn giản
- Các loại cốc đun và ống nghiệm
- Các loại chén, bát nung (sứ, thạch anh, kim loại quý…)
- Các loại ống nghiệm đun được (chịu nhiệt)
- Lò nung, tủ sấy
- Các loại hệ chiết lỏng-lỏng, lỏng-rắn và lỏng-khí
- Bình Kendan các loại
2.3.3. Các loại trang bị hoàn chỉnh
- Các loại hệ chưng cất khác nhau
- Hệ thống bình Kendan đóng kín, hồi lưu và tự động
- Các loại lò vi song (đơn giản và hoàn chỉnh)
- Các hệ của kỹ thuật chiết lỏng lỏng lien tục
- Các hệ của kỹ thuật chiết lỏng-rắn (chiết pha rắn)
- Các hệ của kỹ thuật chiết khí-rắn (chiết pha khí)
- Các hệ của kỹ thuật chiết siêu âm
- Các trang bị của kỹ thuật chiết Soxhlet
- Các loại thiết bị thăng hoa mẫu
- Các loại khác
Song một điều phải nhớ rằng dù chọn cách nào, dụng cụ nào thì cũng phải đảm bảo xử lý được mẫu một cách tốt nhất mà không làm mất chất phân tích, không làm nhiễm bẩn và đưa được chất cần xác định về dạng phù hợp nhất cho phương pháp phân tích đã chọn. Các loại trang thiết bị này sẽ được nói đến trong các kỹ thuật xử lý mẫu cụ thể.
2.4. Khái quát về bản chất các kỹ thuật xử lý mẫu
Xử lý mẫu phân tích là một quá trình phức tạp, có hóa học, hóa lý hay vật lý và hóa học phức tạp kết hợp để chuyển các chất hay các nguyên tố hay các ion cần xác định có trong mẫu phân tích ban đầu, đưa chúng về dạng tan trong một dung môi thích hợp như nước hay dung môi hữu cơ để sau đó có thể xác định được nó theo một phương pháp phân tích thích hợp. Tuy thế, nhưng việc xử lý mẫu phân tích là được thực hiện theo rất nhiều kỹ thuật có nguyên lý, bản chất, cơ chế vật lý và hóa học có khi rất khác nhau tùy theo mỗi loại mẫu và yêu cầu phân tích những chất nào. Ví dụ như xử lý bằng acid, xử lý bằng kiềm, hay tro hóa khô, tro hóa ướt, sự chiết lỏng lỏng, chiết pha rắn, chưng cất…. Song một cách đại thể thì chúng ta có thể phân loại theo một số nguyên tắc, cơ chế dựa theo các cơ chế sau đây của hóa học, hóa lý và vật lý trong quá trình xử lý mẫu.
Vì thế trong chương này chỉ trình bày về các nguyên tắc, bản chất… của các kỹ thuật xử lý mẫu phân tích, mà không đi sâu vào cấu tạo và cách vận hành các loại dụng cụ hay trang thiết bị. Đó là các kỹ thuật sau đây:
- Kỹ thuật vô cơ hóa ướt
- Kỹ thuật vô cơ hóa khô
- Kỹ thuật vô cơ hóa khô ướt kết hợp
- Các kỹ thuật chiết thông thường
- Kỹ thuật chiết Soxhlet (kiểu thường và tự động)
- Kỹ thuật chiết pha rắn, pha khí
- Kỹ thuật chiết siêu âm
- Các kỹ thuật chưng cất (thường, chân không, lôi cuốn…)
- Kỹ thuật lên men nấu
- Kỹ thuật thăng hoa chất phân tích
- Kỹ thuật chlor hóa mẫu bằng khí chlorine mới sinh
- Kỹ thuật điện phân
Trong các kỹ thuật đó, mỗi kỹ thuật chỉ thích hợp cho một số chất hay một nhóm chất nhất định và mội kỹ thuật cũng có một số ưu và nhược điểm riêng và phạm vi ứng dụng của nó. Nghĩa là không thể có một cách xử lý mẫu nào là phù hợp được cho mọi loại mẫu, mọi chất phân tích. Vì thế tùy theo yêu cầu cụ thể của công việc phân tích mà người làm phân tích phải nghiên cứu, xem xét và lựa chọn một kỹ thuật nào cho thích hợp trong cơ sở của mình và đảm bảo được kết quả phân tích đúng đắn và tin tưởng. Tức là phải thực hiện QA/QC trong công việc xử lý và trong công việc phân tích đặt ra.
Trong khi xử lý hay phân hủy mẫu, có thể có rất nhiều quá trình vật lý và các phản ứng hóa học có thể xảy ra đồng thời, tùy thuộc vào mỗi loại nền mẫu, thành phần của mẫu và các chất được cho vào dùng để thực hiện xử lý mẫu. Nói chung một cách tổng thể có thể có các quá trình sau đây xảy ra:
- Sự phá vỡ mạng lưới cấu trúc của chất mẫu ban đầu, giải phóng các chất phân tích, đưa chúng về dạng dung dịch dưới dạng các muối tan của các ion.
- Quá trình oxy hóa khử làm thay đổi hóa trị, chuyển đổi dạng, làm tan vỡ cấu trúc vật chất mẫu ban đầu để giải phóng chat phân tích về dạng hợp chất tan trong dung dịch.
- Sự đốt cháy, phá hủy các hợp chất hữu cơ và mùn, tạo ra khí CO2, NO2, SO2, nước và giải phóng các kim loại trong chất mẫu hữu cơ ban đầu, đưa chúng về dạng các hợp chất hay muối dễ tan trong acid.
- Sự tạo ra các hợp chất phức bền, ít phân ly làm tan chất mẫu, tạo ra các phức dạng tan của các chất phân tích trong dung dịch (dung môi) qua đó mà hòa tan chất mẫu.
- Tạo ra hợp chất dễ bay hơi, làm mất đi anion của chất mẫu ban đầu… làm mẫu bị phân hủy tạo ra các chất khác tan trong dung dịch acid hay kiềm hay acid.
- Sự kết tinh hay kết tủa chất phân tích dưới dạng hợp chất khác, làm chất phân tích được tách ra khỏi mẫu ban đầu và chuyển sang hợp chất mới mà chúng ta lấy được chúng ra khỏi mẫu ban đầu.
Như vậy trong quá trình xử lý và phân hủy mẫu có thể có các quá trình vật lý, các phản ứng hóa học xảy ra như phản ứng oxy hóa khử, phản ứng thủy phân, phản ứng tạo phức, phản ứng hòa tan, phản ứng kết tủa… của các phân tử chất mẫu với dung dịch acid phân hủ mẫu và các phân tử chất có trong mẫu với nhau.
Đó là nói chung tất cả các khả năng có thể có, song trong thực tế, tùy thuộc vào thành phần và bản chất của mỗi loại mẫu, loại chất phân tích, phương pháp phân tích, hóa chất xử lý mẫu mà có những quá trình xảy ra với loại mẫu đó khi xử lý. Sau đây chúng ta sẽ xem xét một số kỹ thuật xử lý mẫu đã có và đang được dùng.
2.4.1. Kỹ thuật vô cơ hóa ướt (xử lý ướt)
2.4.1.1. Bằng acid mạnh, đặc và có tính oxy hóa
- Nguyên tắc và bản chất
Dùng acid mạnh HCl, H2SO4 hay các acid mạnh, đặc có tính oxy hóa mạnh (HNO3, HClO4) hay hỗn hợp 2 acid (HNO3-H2SO4) hay 3 acid (HNO3-H2SO4-HClO4) để phân hủy mẫu trong điều kiện đun nóng trong bình Kendan hay trong ống nghiệm. Lượng acid thường gấp 20-15 lần lượng mẫu, tùy loại mẫu. Thời gian hòa tan mẫu (xử lý) trong các hệ hở, bình Kendan thường từ vài giờ tới vài chục giờ, cũng tùy loại mẫu, bản chất của các chất. Còn nếu trong lò vi song hệ kín (có áp suất) thì chỉ cần 50-60 phút. Dưới tác dụng của acid đặc và nhiệt độ, ở đây cũng có các quá trình vật lý và hóa học sau đây xảy ra, ví dụ:
- Sự phá vỡ mạng cấu trúc của chất mẫu, giải phóng các chất phân tích đưa chúng và dung dịch dưới dạng các muối tan.
- Quá trình oxy hóa khử làm thay đổi hóa trị, chuyển đổi dạng, làm tan vỡ các chất mẫu, để giải phóng chất phân tích về dạng muối tan trong dung dịch.
- Nếu xử lý mẫu hữu cơ phân tích kim loại thì có sự đốt cháy, phá hủy các hợp chất hữu cơ và mùn tạo ra khí CO2, nước và giải phóng các kim loại trong chất mẫu hữu cơ về dạng muối vơ cơ tan trong dung dịch.
- Tạo ra hợp chất dễ bay hơi, làm mất đi anion trong phân tử chất mẫu… làm mẫu bị phân hủy tạo ra các hợp chất khác tan trong dung dịch.
- Như vậy trong quá trình xử lý mẫu ở đây cũng có thể có các phản ứng hóa học xảy ra như phản ứng oxy hóa khử, phản ứng thủy phân, phản ứng tạo phức, phản ứng hòa tan, phản ứng kết tủa… của các phần tử chất mẫu với các acid dùng để phân hủy mẫu và các chất có trong mẫu với nhau.
Sau đây là một vài ví dụ thể hiện các quá trình trên, khi xử lý mẫu phân tích khác nhau:
- ví dụ 1: hòa tan quặng mangan oxide bằng HNO3và H2O2.
+ MnO2 + HNO3 + H2O2 à Mn(NO3)2 + H2O + NO2.
- Ví dụ 2: hòa tan quặng sắt bằng vương thủy
+ Fe2O2.Fe3O4+ HNO3 + HCl à FeCl3 + NO2 + H2O
- ví dụ 3: xử lý mẫu thực phẩm, rau quả
+ Nền mẫu + HNO3 + H2SO4à CO2 + H2O + muối kim loại hòa tan
Các dung dịch acid dùng để hòa tan và xử lý mẫu: trong xử lý ướt, người ta thường dùng các loại dung dịch acid đặc, song tất nhiên chọn loại nào là tùy thuộc vào bản chất của nền mẫu và chất phân tích tồn tại trong mẫu đó
- Các đơn acid đặc HCl, H2SO4, HNO3, HClO4.
- Hỗn hợp 2 acid: cường thủy, HNO3-H2SO4, HF-H2SO4…
- Hỗn hợp 3 acid: HCl-HNO3-H2SO4, HNO3-H2SO4-HClO4.
- Hỗn hợp 1 acid và 1 chất oxy hóa: H2SO4-KMnO4, HNO3-H2O2,…
- Hỗn hợp 2 acid và 1 muối: HNO3-H2SO4-KMnO4,…
Nhiệt độ khi xử lý mẫu là phụ thuộc vào nhiệt độ sôi của acid dùng để phân hủy mẫu. Khi dùng hỗn hợp acid thì nhiệt độ xử lý mẫu còn tùy thuộc thêm vào thành phần của hỗn hợp acid và thông thường nhiệt độ này nằm trong giới hạn giữa nhiệt độ sôi của acid dễ sôi nhất và acid khó sôi chất. Đối với những mẫu khó phân hủy, ta phải dùng các acid hoặc hỗn hợp các acid có nhiệt độ sôi cao và tính oxy hóa mạnh.
Acid | HCl | HNO3 | H2SO4 | H3PO4 | HClO4 | HF |
C (%) | 36 | 65 | 98 | 78 | 72 | 40 |
Tsôi (oC) | 110 | 121 | 340 | 213 | 203 | 120 |
- Các loại hay kiểu xử lý ướt
Việc xử lý mẫu theo phương pháp ướt có thể được thực hiện trên các loại trang thiết bị khác nhau, tùy thuộc vào khả năng phòng thí nghiệm và tính chất của mẫu
- Trong điều kiện thường, thiết bị đơn giản
+ Trong cốc thủy tinh, đun nóng trên bếp điện hay đun cách thủy.
+ Trong bình Kendan thường
+ Trong bình Kendan có hồi lưu…
- Trong nồi áp suất cao: mẫu và acid được đặt trong các hộp kín sau đó đặt trong
+ Tủ sấy, bếp cách cát, lò nung…
+ Luộc trong nồi nước sôi hay dầu sôi
- Trong lò vi song (gồm hệ kín và hở)
+ Hệ đơn giản: hệ bình hở hay hệ kín nhưng không điều khiển nhiệt độ, áp suất
+ Hệ nhiều bình, tự động hoàn toàn: hệ hở (có giám sát nhiệt độ) và hệ kín (có giám sát nhiệt độ và áp suất).
Trong các kiểu xử lý trên, kỹ thuật xử lý ướt với acid đặc có tính oxy hóa mạnh trong bình Kendan hay trong lò vi sóng hệ kín đang được sử dụng rộng rãi, phổ biến. Ở các nước phát triển, lò vi sóng hệ kín được sử dụng một cách phổ biến trong xử lý mẫu do nó triệt để, nhanh, hạn chế mất chất phân tích và nhiễm bẩn và tiêu tốn ít hóa chất.
- Một số thí dụ về xử lý mẫu theo cách tro hóa ướt
- Ví dụ 1: Hòa tan mẫu kim loại và hợp kim Cu hay Al bằng acid HNO3; lấy 1 g mẫu đã nghiền nhỏ (hay ở dạng phoi bào) vào bình Kendan, tẩm ướt bằng vài giọt nước cất, thêm 10 mL HNO3 65%, 4 mL H2SO4 98%, lắc đều, cắm phễu nhỏ vào bình Kendan, đun nhẹ cho mẫu sôi và phân hủy cho đến khi dung dịch mẫu trong. Sự hòa tan ở đây đã làm thay đổi hóa trị và trạng thái của Ca, Al kim loại trong hợp kim, chuyển chúng thành muối tan trong dung dịch. Phản ứng hóa học chính xảy ra là:
Al + HNO3 à Al(NO3)3 + NO2+ H2O
Cu + HNO3 à Cu(NO3)2 + NO2+ H2O
- Ví dụ 2: hòa tan mẫu thép chrome bằng hỗn hợp acid HNO3 và HCl hay HNO3 và H2SO4. Lấy 0.5 g mẫu đã nghiền nhỏ (hay dạng phoi bào) vào bình Kendan, tẩm ướt bằng vài giọt nước cất, thêm 15 mL HNO3 65%, 4 mL H2SO498%, lắc đều và đun nhẹ cho mẫu sôi và phân hủy, cho đến khi dung dịch mẫu trong. Quá trình này có sự oxy hóa khử của Cl và N để sinh ra Cl mới sinh phục vụ cho phân hủy mẫu. Dưới tác động của hỗn hợp acid đặc này và có nhiệt độ, mạng lưới kim loại bị phá vỡ, các kim loại chuyển vào dung dịch dưới dạng các muối tan. Phản ứng hóa học chính xảy ra ở đây là:
Ni-Cr-Fe + HNO3 + HCl à Ni(NO3)2 + Fe(NO3)3+ Cr(NO3)3 + NO2 + H2O
- Ví dụ 3: hòa tan quặng Mn oxide bằng hỗn hợp HNO3-H2O2. Để xác định Mn và các tạp kim loại trong quặng này, quá trình hòa tan có sự oxy hóa khử, chuyển Mn(IV) về Mn(II) tan trong dung dịch. Lấy 1 g mẫu quặng đã nghiền nhỏ vào bình Kendan, tẩm ướt bằng vài giọt nước cất, thêm 15 mL HNO3 65%, 2 mL H2O230%, lắc đều và đun nhẹ cho mẫu sôi và phân hủy cho đến khi dung dịch mẫu trong. Phản ứng hóa học xảy ra là:
MnO2 + HNO3 + H2O2 à Mn(NO3)2 + H2O + O2
- Ví dụ 4: Xử lý mẫu rau quả bằng hỗn hợp hai acid HNO3-H2SO4, trong bình Kendan, để xác định các kim loại nặng, độc hại, như Cd, Cu, Fe, Mn, Ni, Pb, Zn. Lấy 5 g mẫu đã nghiền mịn và trộn đều vào bình kendan, thêm 60 mL HNO365%, 5 mL H2SO4 98%, lắc đều và đun nhẹ cho mẫu sôi và phân hủy, cho đến khi dung dịch mẫu trong không màu (6-8h tùy loại mẫu). Chuyển dung dịch mẫu vào cốc đun 250 mL, làm bay hơi hết dung dịch acid cho đến khi còn muối ẩm, để nguội, định mức bằng dung dịch HCl 2% thành 25 mL. Trong quá trình xử lý này, các nguyên tố kim loại dưới dạng các hợp chất cơ kim của mẫu rau quả sẽ bị acid đặc oxy hóa, đốt cháy các chất hữu cơ, đưa các kim loại về các muối vô cơ tan trong dung dịch nước. Quá trình hóa học chính:
Nền mẫu + HNO3 + H2SO4à Mex(NO3)x+ Men(SO4)m + H2O + CO2+ NO2.
- Ví dụ 5: Xử lý mẫu thịt cá tươi sống bằng hỗn hợp 2 acid HNO3-H2SO4 trong bình Kendan để xác định các kim loại độc hại như Cd, Cu, Fe, Mn, Ni, Pb, Zn. Lấy 5 g mẫu đã nghiền mịn và trộn đều vào bình Kendan, thêm 60 mL HNO3 65%, 8 mL H2SO4 98%, cắm phễu nhỏ vào bình Kendan, lắc đều và đun nhẹ cho mẫu sôi và phân hủy, cho đến khi dung dịch mẫu trong không màu (6-8h tùy loại mẫu). Chuyển dung dịch mẫu vào cốc đun 250 mL, làm bay hơi hết dung dịch acid cho đến khi còn muối ẩm, để nguội, thêm 5 mL dung dịch HCl 10%, định mức bằng nước cất thành 25 mL. Trong quá trình xử lý này, các nguyên tố kim loại dưới dạng các hợp chất cơ kim của mẫu rau quả sẽ bị acid đặc oxy hóa, đốt cháy các chất hữu cơ, đưa các kim loại về các muối vô cơ tan trong dung dịch nước.
Tất cả các mẫu trong ví dụ 1-3 có thể xử lý trong lò vi sóng hệ kín và lượng acid chỉ cần dùng ½ là nhiều. Thời gian xử lý chỉ trong 50-60 phút là xong. Còn xử lý như trên thì phải mất từ 6-10 giờ mà lại không triệt để bằng xử lý trong lò vi sóng.
- Ưu nhược điểm và phạm vi ứng dụng
Các ưu và nhược điểm chính của kỹ thuật này là:
- Không mất các chất phân tích
- Nhưng thời gian phân hủy mẫu rất dài, nếu không dùng lò vi sóng
- Tốn nhiều acid đặc nhất là khi sử dụng các hệ hở
- Dễ bị nhiễm bẩn khi xử lý bằng hệ hở do môi trường hay acid dùng nhiều
- Phải đuổi acid dư nên dễ bị nhiễm bẩn do bụi, hay mất mẫu
Ứng dụng chủ yếu của kỹ thuật này là để xử lý mẫu phân tích và một số anion vô cơ như halides, arsenate, sulfate, phosphate... trong các loại mẫu sinh hoạt, mẫu hữu cơ, vô cơ, mẫu môi trường, mẫu đất, nước, bụi, không khí, mẫu kim loại, hợp kim... Kỹ thuật này không dùng được cho việc xử lý tách các chất hữu cơ để phân tích vì trong các điều kiện này, các chất hữu cơ bị phá hủy hết.
2.4.1.2. Xử lý mẫu bằng dung dịch kiềm mạnh đặc nóng.
- Nguyên tắc chung
Trong phương pháp này người ta thường dùng các dung dịch kiềm mạnh (NaOH, KOH) đặc hay hỗn hợp kiềm mạnh và muối kim loại kiềm (NaOH-NaHCO3) hay hỗn hợp kiềm mạnh và peroxide (NaOH-Na2O2), nồng độ lớn (10-20%) để phân hủy mẫu trong điều kiện đun nóng trong bình Kendan, trong hộp kín hay trong lò vi sóng.
Trong quá trình xử lý, dưới tác động của kiềm và nhiệt độ cao, có thể xảy ra:
- Phá vỡ cấu trúc nền mẫu, chuyển chất phân tích về dạng dung dịch
- Các chất của mẫu tương tác với kiềm tạo ra sản phẩm tan được
- Có thể sinh ra các khí bay ra giúp mẫu hòa tan tốt hơn
- Có thể tạo ra các hợp chất bền, ít phân ly và tan trong dung dịch
- Tạo ra các sản phẩm kết tủa với nền mẫu
- Các cách hòa tan và dung dịch hòa tan
Theo kỹ thuật xử lý này, chúng ta có thể dùng các dung dịch của các chất sau đây để xử lý mẫu:
- Dung dịch kiềm đặc nóng (NaOH, KOH: 10-20%)
- Dung dịch kiềm đặc nóng có chất oxy hóa mạnh (NaOH-Na2O2)...
- Hỗn hợp kiềm đặc nóng có chất khử mạnh.
- Hỗn hợp kiềm mạnh và muối của nó (NaOH-NaHCO3, NaOH-Na2CO3)
Quá trình phân hủy được thực hiện khi đun sôi dung dịch mẫu, trong một thời gian nhất định, thường là từ 6-10 giờ trong bình Kendan hở. Còn nếu trong lò vi sóng hệ kín (áp suất cao) thì chỉ mất khoảng 40-60 phút.
Nhiệt độ sôi của các dung dịch kiềm tùy thuộc vào thành phần, nồng độ của dung dịch kiềm sử dụng để xử lý mẫu. Nói chung trong khoảng từ 115-230 oC và đây là yếu tố thúc đẩy phản ứng xảy ra nhanh.
- Vài ví dụ ứng dụng
- Ví dụ 1: hòa tan oxid nhôm bằng dung dịch naOH 10% nóng. Lấy 0.5 g mẫu dạng bột vào bình Kendan, tẩm ướt bằng vài giọt nước cất, thêm 10 mL NaOH 10%, đun sôi để hòa tan mẫu. Cơ chế ở đây là chuyển trạng thái tinh thể rắn oxid sang dạng ion tan trong dung dịch theo phản ứng:
Al2O3 + NaOH à NaAlO2 + H2O
- Ví dụ 2: Hòa tan quặng silicate bằng dung dịch NaOH 20% nóng. Lấy 0.5 g mẫu dạng bột vào bình Kendan, tẩm ướt bằng vài giọt nước cất, thêm 15 mL NaOH 20%, đun sôi để hòa tan mẫu. Cơ chế ở đây là chuyển trạng thái tinh thể rắn sang ion tan trong dung dịch và bền ở dạng muối Na2SiO3 theo phản ứng
SiO2.nX + NaOH à Na2SiO3 + H2O + nX
- Ưu nhược điểm và phạm vi ứng dụng
Kỹ thuật tro hóa ướt này cũng có ưu điểm là không làm mất các chất phân tích nhất là các nguyên tố và hợp chất dễ bay hơi. Nhưng mà có một nhược điểm lớn nhất là tốn nhiều kiềm tinh khiết cao, thường phải dùng gấp từ 10-15 lần nhu cầu cần thiết mới có thể xử lý được mẫu và vì vậy khả năng nhiễm bẩn rất cao. Sau khi xử lý mẫu, phải loại bỏ lượng kiềm dư bằng cách trung hòa với acid, song lại làm loãng mẫu. Đây là một phần việc khó khăn và mất nhiều thời giờ và cũng hay là nhiễm bẩn mẫu. Vì thế cách này chỉ được dùng cho một số trường hợp khi không có cách lựa chọn nào khác. Ví dụ khi phân hủy mẫu xác định các anion vô cơ như halides, nitrate, phosphate, sulfate... trong các dối tượng không xử lý được bằng phương pháp acid.
2.4.1.3. Xử lý ướt trong lò vi sóng
- Nguyên tắc
Kỹ thuật xử lý mẫu ướt trong lò vi sóng thực chất cũng là phân hủy mẫu khi đun nóng bằng dung dịch acid mạnh, đặc có tính oxy hóa hay bằng dung dịch kiềm đặc nóng như đã nêu bên trên. Tác nhân phân hủy là các acid và năng lượng nhiệt cung cấp cho mẫu do hiện tượng truyền nhiệt do đối lưu từ một nguồn nhiệt bên ngoài. Đối với lò vi sóng, năng lượng đun nóng mẫu được cung cấp bằng bức xạ vi sóng tần số cao, các phân tử mẫu đều được nhận năng lượng đồng đều và trực tiếp từ nguồn vi sóng, phá vỡ cấu trúc nền mẫu từ phía trong ra, vì thế quá trình xử lý mẫu nhanh và triệt để hơn. Hơn nữa, đối với hệ kín còn có áp suất cao và nhiệt độ cao do đó hiệu quả cao và rất nhanh lại tốn ít acid so với phân hủy ở điều kiện thường trong bình Kendan. Các quá trình vật lý và hóa học xảy ra khi xử lý mẫu bằng vi sóng cũng tương tự như cách xử lý mẫu ướt thông thường khác nhưng có tốc độ nhanh hơn và triệt để hơn.
- Trang thiết bị
Việc xử lý mẫu trong lò vi sóng có thể thực hiện trong hệ bình hở hay trong hệ bình kín. Các thiết bị này ngày nay đã hiện diện trên thị trường với nhiều loại, kích cỡ khác nhau, phục vụ cho từng mục đích nhất định. Các thiết bị này lại có nhiều kiểu rotor khác nhau có thể thay đổi được như rotor để phân hủy mẫu, rotor để làm bay hơi dung môi và acid, rotor dùng để chiết, rotor dùng sấy mẫu, rotor dùng để nung mẫu (như lò nung cao tần)... vì thế rất thuận tiện cho công việc xử lý mẫu phân tích. Kỹ thuật này được sử dụng phổ biến ở các nước phát triển.
- Các ví dụ ứng dụng
Từ các ví dụ đã trình bày trong mục 2.4.1.1.c và 2.4.1.2.c đều có thể thực hiện trong các hệ hở. Tuy vậy nếu được thực hiện trong hệ kín thì lượng hóa chất tiêu hao chỉ khoảng ½ và thời gian rút ngắn xuống còn từ 40-60 phút mà hiệu quả xử lý lại triệt để hơn, ít mất chất phân tích hơn.
2.4.2. Kỹ thuật vô cơ hóa khô (xử lý khô)
2.4.2.1. Nguyên tắc và quá trình xảy ra trong xử lý
Kỹ thuật tro hóa kho là kỹ thuật nung để xử lý mẫu, song thực chất chỉ là bước đầu tiên của quá trình xử lý mẫu vì sau khi nung, mẫu bã còn lại cần phải được hòa tan (xử lý tiếp) bằng dung dịch muối hay dung dịch acid phù hợp để chuyển chất phân tích vào dung dịch cho một phương pháp phân tích đã chọn. Quá trình nung xử lý mẫu có thể không thêm chất phụ gia, chất bảo vệ hoặc có thêm các chất này vào mẫu để trợ giúp quá trình xử lý được xảy ra nhanh hơn, tốt hơn và hạn chế mất mát chất phân tích.
Trong quá trình nung xử lý mẫu, có thể có các quá trình vật lý và hóa học sau đây xảy ra tùy theo bản chất, thành phần của mỗi loại mẫu và phụ gia thêm vào, ví dụ như
- Làm bay hơi nước hấp phụ và nước kết tinh trong mẫu
- Sự tro hóa, đốt cháy chất mùn, các chất hữu cơ khác của mẫu
- Phá vỡ cấu trúc ban đầu của nền mẫu, chuyển sang các nền đơn giản hơn
- Chuyển dạng các chất phân tích từ phức tạo sang đơn giản
- Quá trình oxy hóa – khử thay đổi số oxy hóa của các nguyên tố trong mẫu
- Giải phóng một số khí như CO, CO2, SO2…
- Có một số tương tác hóa học giữa các chất trong mẫu với nhau và với phụ gia thêm vào tạo ra các chất mới.
Tất cả các quá trình đó góp phần là tan vỡ mẫu ban đầu, để hòa tan chất phân tích vào dung dịch. Bảng sau đây là vài ví dụ về sự nung một số mẫu phân tích trong điều kiện có và không có chất phụ gia
Bảng 2.1: ví dụ về các quá trình trong xử lý khô trong lò nung
Loại mẫu | Phụ gia | Nhiệt độ | Sản phẩm sau khi nung |
Đất sét | KOH-Na2O2 | 550-650 | Na2SiO3-K2SiO3-H2O |
Quặng silicate | KOH-Na2O2 | 500-600 | Na2SiO3-K2SiO3-H2O-MeX |
Quặng Ferit | 550-600 | FeO-Fe2O3-SO2-H2O | |
Quặng CuS | 550-600 | CuO-SO2-H2O-MenXm | |
Dolomit | 550-650 | CaO-MgO-H2O-CO2-MenXm | |
LnCO3F.xH2O | 550-650 | Ln2O3-CO2-HF-H2O-MenXm | |
Nhựa đường | 550-650 | MexOy-CO2-SO2-H2O-MenXm | |
Thực phẩm | KNO3-HNO3 | 500-550 | MexOy-CO2-H2O-KxXy-NO |
Rau quả | KNO3-HNO3 | 500-550 | MexOy-CO2-H2O-KxXy-NO |
Rau quả | 500-550 | MexOy-CO2-H2O-MexXy | |
Chất hữu cơ | 500-600 | MexOy-CO2-H2O-NO2 |
Đó là những quá trình có thể xảy ra và tất nhiên là đa dạng và phức tạp, và xảy ra như thế nào là tùy vào thành phần của nền mẫu, các điều kiện nung như nhiệt độ, môi trường nung là không khí hay khí trơ, có phụ gia hay không trong đó nhiệt độ là yếu tố chính. Kết quả của quá trình nung là sản phẩm có thành phần có thể đơn giản hơn (như trong bảng trên) và vì vậy tan trong các dung dịch acid hay kiềm loãng.
Kỹ thuật vô cơ hóa khô thường được dùng cho các mẫu hữu cơ, xử lý để xác định các kim loại và các mẫu quặng vô cơ có cấu trúc bền vững rất khó tan trong ngay cả các acid hay kiềm mạnh. Việc tro hóa cũng có thể được thực hiện khi có hoặc không có thêm các phụ gia bảo vệ vào mẫu. Các chất bảo vệ thường được dùng trong quá trình xử lý mẫu này là
- Các acid mạnh đặc: HNO3,H2SO4,H3PO4...
- Một số muối: KNO3, Ca(NO3)2, Mg(NO3)2, LiBO2, Na2B4O7...
- Hỗn hợp acid-muối: Mg(NO3)2-HNO3, HNO3-H2SO4,...
- Hỗn hợp kiềm-muối: KOH-NaHCO3, KOH-Na2SO4,...
- Hỗn hợp muối-peroxide: KHCO3-Na2O2, NaHCO3-Na2O2,...
- Hỗn hợp kiềm mạnh-peroxide: NaOH-Na2O2, KOH-Na2O2,...
- Hỗn hợp kiềm-muối-chất oxy hoá: KOH-NaHCO3-Na2O2...
- Một acid mạnh, đặc và một chất tạo phức
Sau đây chúng ta chỉ điểm qua một vài ví dụ của hai cách nung xử lý mẫu theo kỹ thuật tro hóa đã đề cập ở trên
2.4.2.2. Trang bị để xử lý mẫu khô
Các trang bị để xử lý mẫu khô thường không đa dạng, bao gồm hai loại chính
- Trang bị thông thường: tủ sấy và lò nung các loại
- Trang bị hiện đại: các loại lò vi sóng
2.4.2.3. Tro hóa không không có phụ gia bảo vệ và chất chảy
Nung mẫu không có phụ gia và chất bảo vệ là quá trình xử lý mẫu sơ bộ nhờ tác dụng của nhiệt độ thích hợp trong một thời gian nhất định để phá vỡ mạng tinh thể ban đầu của mẫu phân tích để chuyển nó sang dạng khác, đơn giản hơn, dễ hòa tan vào dung dịch acid hay kiềm trong các giai đoạn xử lý mẫu kế tiếp. Sau đây là một vài ví dụ:
- Ví dụ 1: tro hóa khô mẫu rau quả để xác định kim loại (Na, K, Ca, Mg, Cd, Co, Cr, Cu, Fe, Mn, Ni, Pb, Zn). Cân 5 g mẫu vào chén thạch anh, đem sấy khô từ từ cho đến khi mẫu khô đen, rồi đem nung 3 giờ đầu ở nhiệt độ 450oC, sau đó nâng lên 530-550oC cho đến khi mẫu hết than đen, thu được mẫu tro trắng. Hòa tan tro thu được trong 10 mL dung dịch HCl 15%, đun nhẹ cho tan hết, định mức thành 25 mL bằng nước cất. Các nguyên tố Cd, Cu, Pb Zn sẽ bị mất một ít (8-15%) khi nung.
- Ví dụ 2: Tro hóa khô mẫu dầu mỏ (dầu thô) để xác định các kim loại (Na, K, Ca, Mg, Cd, Co, Cr, Cu, Fe, Mn, Ni, Pb, Zn). Cân lấy 5 g mẫu vào bát hay cốc thạch anh, đun nhẹ trên bếp điện hay sấy khô mẫu từ từ sau đó đem nung ở nhiệt độ 450oC trong 3 giờ, sau đó nâng lên 530-550oC đến khi hết than đen, thu được mẫu tro trắng. Hòa tan tro thu được trong 15 mL dung dịch HCl 18%, đun nhẹ cho tan hết, định mức thành 25 mL bằng nước cất. Các nguyên tố Cd, Cu, Pb Zn sẽ bị mất một ít (8-15%) khi nung.
Theo cách này thông thường một số nguyên tố trong mẫu bị mất khi nung như Cd (10-18%), Cu (7-12%), Pb (8-15%)... và lượng mất đi lại không ổn định, không kiểm soát và khống chế được trong quá trình nung. Sự mất mát này càng nhiều khi nhiệt độ nung mẫu càng cao hay thời gian nung càng lâu và gây vì vậy là một nguồn sai số lớn cho kết quả phân tích. Như ví dụ 1, nếu nung mẫu ở nhiệt độ 530oC, Cd và Pb sẽ mất từ 8-10% nhưng khi nung ở 600oC thì Cd và Pb sẽ mất đến gần 20%.
2.4.2.4. Tro hóa có phụ gia và chất chảy bảo vệ
Nung xử lý mẫu có chất phụ gia và chất bảo vệ cũng là quá trình xử lý mẫu sơ bộ nhờ tác động của nhiệt độ có thêm tương tác hỗ trợ của chất phụ gia, thường là chất chảy, acid đặc..., trong thời gian nhất định để phá vỡ cấu trúc tinh thể dạng ban đầu của mẫu phân tích, chuyển chúng sang dạng dễ hòa tan hơn trong acid hay kiềm. Khi có chất chảy, nhiệt độ nung thường thấp hơn so với khi không có chất chảy, thời gian ngắn hơn song lại triệt để hơn nhất là các mẫu phân tích có matrix bền, chịu nhiệt hay mẫu hữu cơ thì tác dụng của chất phụ gia và bảo vệ lại càng quan trọng. Trong hai ví dụ trên, nếu xử lý mẫu có chất bảo vệ thì không xảy ra sự mất mát các nguyên tố như trên.
Ví dụ 1: tro hóa mẫu rau quả để xác định kim loại (Na, K, Ca, Mg, Cd, Co, Cr, Cu, Fe, Mn, Ni, Pb, Zn) dùng chất phụ gia. Cân 5 g mẫu vào chén thạch anh, thêm 1 g KNO3, 5 mL HNO365%, trộn đều và đun nhẹ cho mẫu sôi đều và cho đến khô đen. Nung mẫu ở nhiệt độ 450oC trong 3 giờ, sau đó nâng lên 500-530oC, đến khi hết than đen, thu được mẫu tro trắng. Hòa tan tro thu được trong 15 mL dung dịch HCl 18%, đun nhẹ cho tan hết, định mức thành 25 mL bằng nước cất.
Ví dụ 2: Tro hóa khô mẫu dầu mỏ (dầu thô) để xác định các kim loại (Na, K, Ca, Mg, Cd, Co, Cr, Cu, Fe, Mn, Ni, Pb, Zn) dùng chất phụ gia là 2 g KNO3 và 10 g sodium benzene sulfonate. Cân lấy 5 g mẫu vào bát hay cốc thạch anh, thêm chất phụ gia, đun nhẹ cho mẫu sôi và cho đến khô đen, sau đó nung ở nhiệt độ 450oC trong 3 giờ, sau đó nâng lên 500-530oC đến khi hết than đen, thu được mẫu tro trắng. Hòa tan tro thu được trong 15 mL dung dịch HCl 18%, đun nhẹ cho tan hết, định mức thành 25 mL bằng nước cất.
Ví dụ 3: Tro hóa mẫu sữa để xác định kim loại (Na, K, Ca, Mg, Cd, Co, Cr, Cu, Fe, Mn, Ni, Pb, Zn), dùng chất phụ gia là 8 mL H2SO4 45% và 2 g KNO3 hay LiBO2. Lấy 5 g mẫu vào chén thạch anh, thêm chất phụ gia, trộn đều, sấy cẩn thận cho mẫu khô (mẫu dễ bị sủi bọt và bắn ra ngoài) và thành than đen sau đó nung ở nhiệt độ 450oC trong 3 giờ, sau đó nâng lên 500-530oC đến khi hết than đen, thu được mẫu tro trắng. Hòa tan tro thu được trong 15 mL dung dịch HCl 18%, đun nhẹ cho tan hết, tiếp tục đun đuổi acid cho đến khi còn muối ảm. Định mức thành 25 mL bằng HCl 2%.
Ví dụ 4: Xử lý mẫu xác định As trong quăng hay bã thải rắn. Lấy 0.5 g mẫu quặng vào chén Zr, thêm 4 g KOH, đun nhẹ cho hỗn hợp chảy lỏng, thêm cẩn thận 5 g Na2O2, lắc đều và nung ở 700 oC trong 10 phút, để nguội, lấy chén chứa mẫu ra, lau sạch bên ngoài chén và bỏ cả chén vào cốc dung tích 400 mL chứa sẵn 100 mL nước ấm 70 oC, lắc kỹ cho mẫu tan, lấy chén Zr ra và tráng chén (trong và ngoài) 2 lần bằng 20 mL nước cất. Thêm vài mảnh sứ xốp nhỏ vào cốc, đậy kính đồng hồ và đun sôi nhẹ để đuổi H2O2 (khoảng 15 phút), để nguội. Lọc dung dịch qua giấy băng đỏ, rửa kết tủa và giấy lọc 3 lần bằng 20 mL dung dịch KOH 0.05% nóng. Gộp nước lọc và nước rửa, cô cạn còn khoảng 65 mL, thêm 25 mL HCl 35%, lắc đều và định mức 100 mL. Đây là dung dịch mẫu để xác định As bằng kỹ thuật hydride hóa. Cách xử lý này thích hợp cho các mẫu rắn như quặng sắt, đất đá, rác thải rắn, bùn, trầm tích để xác định As, nhưng hàm lượng Si trong các mẫu này phải nhỏ hơn 10%.
2.4.2.5. Ưu nhược điểm và phạm vi sử dụng
- Thao tác và cách làm đơn giản
- Không phải dùng nhiều acid đặc
- Xử lý mẫu được triệt để nhất là các mẫu có matrix hữu cơ
- Không lâu như phương pháp xử lý ướt thông thường
- Nhược điểm: có thể mất một số chất dễ bay hơi như Cd, Pb, Zn, Sb, Sn... nếu không dùng chất phụ gia và bảo vệ.
2.4.3. Kỹ thuật vơ cơ hóa tro-ướt kết hợp
2.4.3.1. Nguyên tắc chung
Nguyên tắc của kỹ thuật này là mẫu được phân hủy trong chén hay cốc nung mẫu. Trước tiên người ta thực hiện xử lý ướt sơ bộ trong cốc hay chén nung bằng một lượng nhỏ acid và chất phụ gia để phá vỡ sơ bộ cấu trúc ban đầu của matrix mẫu và tạo điều kiện lưu giữ những chất dễ bay hơi khi nung. Sau đó đem nung ở nhiệt độ thích hợp. Vì thế lượng acid dùng để xử lý mẫu thường chỉ bằng ¼ hay 1/3 lượng cần dùng cho xử lý ướt. Quá trình nung sau đó se nhanh hơn và triệt để hơn, hạn chế bớt sự mất mát chất phân tích so với các cách xử lý mẫu đơn (ướt hay khô)
Các quá trình vật lý và hóa học xảy ra khi xử lý mẫu khô-ướt kết hợp cũng tương tư như các quá trình xảy ra khi xử lý mẫu khô hay ướt, song ở đây là sự kết hợp hai quá trình kế tiếp nhau. Xử lý ướt ban đầu là để bảo vệ một số nguyên tố cho xử lý khô kế tiếp theo không bị mất mẫu. Cách này thích hợp cho các mẫu có matrix là chất hữu cơ, xử lý để xác định kim loại và một số anion.
2.4.3.2. Các phương pháp và ví dụ
Vì là xử lý khô-ướt kết hợp, xử lý khô và ướt kế tiếp nhau nên mọi diễn biến sẽ tương tự như xử lý theo một trong hai kiểu nói trên. Điểm khác biệt đáng kể trong quy trình xử lý mẫu này so với kiểu xử lý mẫu ướt là không phải đuổi acid dư. Sau đây là vài ví dụ.
- Ví dụ 1: Xử lý mẫu rau quả để xác định kim loại (Na, K, Ca, Mg, Cd, Co, Cr, Cu, Fe, Mn, Ni, Pb, Zn), lấy 5 g mẫu cho vào chén nung, thêm 10 mL HNO3 65% và 5 mL Mg(NO3)25%, trộn đều rồi sấy hay đun trên bếp điện cho mẫu sôi nhẹ và đến khô thành than đen. Đem nung ở nhiệt độ 400-450oC trong 3 giờ, sau đó nâng lên 500-530oC đến khi hết than đen, thu được mẫu tro trắng. Hòa tan tro thu được trong 20 mL dung dịch HCl 1:1, đun nhẹ cho tan hết, tiếp tục đun đuổi acid cho đến khi còn muối ảm. Định mức thành 25 mL bằng HCl 2%. Dung dịch này dùng để xác định các nguyên tố nói trên.
- Ví dụ 2:Xử lý mẫu sữa để xác định kim loại (Na, K, Ca, Mg, Cd, Co, Cr, Cu, Fe, Mn, Ni, Pb, Zn),. Lấy 5 g mẫu vào chén nung, thêm 15 mL HNO3, 2 mL H2SO4 98% và 5 mL Mg(NO3)2 5%, trộn đều. Để xử lý mẫu ướt sơ bộ: sấy mẫu cẩn thận trên bếp điện hay trong tủ sấy cho mẫu khô (mẫu dễ bị sủi bọt và bắn ra ngoài) và thành than đen sau đó nung ở nhiệt độ 400-450oC trong 3 giờ, sau đó nâng lên 500-530oC đến khi hết than đen, thu được mẫu tro trắng. Hòa tan tro thu được trong 15 mL dung dịch HCl 1:1, đun nhẹ cho tan hết, tiếp tục đun đuổi acid cho đến khi còn muối ẩm. Định mức thành 25 mL bằng HCl 2%.
- Ví dụ 3: Xử lý mẫu tôm, cua, cá... để xác định các kim loại (Na, K, Ca, Mg, Cd, Co, Cr, Cu, Fe, Mn, Ni, Pb, Zn). Lấy 5 g mẫu vào chén thạch anh, thêm 5 mL H2SO4 98% và 5 mL Mg(NO3)2 5% trộn đều. Để xử lý mẫu ướt sơ bộ: sấy mẫu cẩn thận trên bếp điện cho mẫu khô và thành than đen sau đó nung ở nhiệt độ 400-450oC trong 3 giờ, sau đó nâng lên 500-530oC đến khi hết than đen, thu được mẫu tro trắng. Hòa tan tro thu được trong 15 mL dung dịch HCl 1:1, đun nhẹ cho tan hết, tiếp tục đun đuổi acid cho đến khi còn muối ảm. Định mức thành 25 mL bằng HCl 2%. Đây là dung dịch mẫu dùng để xác định các kim loại nêu trên bằng phương pháp phổ hấp thu phân tử hay phổ nguyên tử
2.4.3.3. Ưu nhược điểm và phạm vi áp dụng
Ưu điểm của kỹ thuật này là tận dụng và kết hợp các ưu điểm của phương pháp xử lý mẫu uớt và khô
- Hạn chế sự mất mát của một số chất phân tích
- Sự tro hóa là triệt để, sau khi hòa tan tro sẽ được dung dịch mẫu trong
- Không phải dùng nhiều acid tinh khiết
- Thời gian xử lý mẫu nhanh hơn tro hóa ướt
- Không phải đuổi nhiều acid dư, hạn chế ô nhiễm môi trường, nhiễm bẩn mẫu
- Phù hợp cho nhiều loại mẫu khác nhau để xác định kim loại
- Không cần trang thiết bị phức tạp, hiện đại, đắt tiền
Cách này được ứng dụng chủ yếu để xử lý mẫu cho phân tích các nguyên tố kim loại và một số anion vô cơ như Cl-, Br-, sulfate, phosphate... trong các loại mẫu sinh học, môi trường, mẫu hữu cơ, vô cơ. Cách xử lý này không dùng được cho xác định các chất hữu cơ. Trong các phòng thí nghiệm bình thường, không được trang bị lò vi sóng thì cách xử lý này vẫn là một phương pháp thích hợp, đơn giản mà vẫn đảm bảo có được kết quả tốt.
2.4.4. Các kỹ thuật chiết
2.4.4.1. Cơ sở, nguyên tắc và điều kiện của sự chiết
- Nguyên tắc và cơ sở của sự chiết
Chiết dựa trên cơ sở sự hòa tan (hay phân bố) khác nhau của chất phân tích vào trong hai dung môi không trộn lẫn vào nhau. Tức là chất phân tích tan tốt trong dung môi này nhưng lại không tan tốt trong dung môi kia, nghĩa là sự phân bố của chất trong hai dung môi là rất khác nhau nhờ đó mà chúng ta lấy được chất phân tích ra khỏi mẫu ban đầu, chuyển nó vào dung môi chúng ta mong muốn sau đó xác định nó trong dung môi chúng ta vừa chiết vào. Như thế yếu tố quyết định sự tách và xử lý mẫu ở đây là hệ số phân bố của chất phân tích trong các phase và điều kiện thực hiện chiết tách.
- Hệ số phân bố của chất
Hệ số phân bố là một hằng số vật lý (hằng số nhiệt động) đặc trưng cho sư chiết. Nó cho ta biết sự phân bố (hay hòa tan) của các chất phân tích trong hai dung môi (hay 2 pha) không trộn lẫn vào nhau theo tỷ lệ hay mức độ nào. Nếu giá trị hằng số này càng lớn thì sự phân bố đó càng khác nhau nhiều vì vậy càng thuận lợi cho sự chiết tách các chất. Ví dụ chất X được phân bố vào hai dung môi không trộn lẫn vào nhau (A và B) thì hệ số phân bố này được xác định theo biểu thức sau
Trong đó CX(A) và CX(B) là nồng độ chất X trong hai dung môi A và B. Nếu hệ số phân bố KD> 99/1 xem như chất X chuyển hoàn toàn vào dung môi A. Đó là điều kiện của quá trình chiết để lấy chất phân tích ra khỏi nền mẫu.
- Các điều kiện của sự chiết
Để có được kết quả chiết tốt, quá trình chiết phải có các điều kiện và đạt được các yêu cầu sau đây
- Dung môi chiết phải có độ tinh khiết cao, đảm bảo không làm nhiễm bẩn chất phân tích
- Dung môi chiết phải hòa tan tốt chất phân tích, nhung không hòa tan tốt các chất có trong mẫu
- Hệ số phân bố chiết phải lớn để sự chiết được triệt để
- Cân bằng chiết nhanh đạt, thuận nghịch để giải chiết được tốt
- Sự phân lớp khi chiết phải rõ ràng, nhanh và dễ tách ra riêng biệt
- Phải chọn pH hay môi trường acid thích hợp
- Chọn nhiệt độ phù hợp
- Phải thực hiện lắc mạnh trong quá trình chiết
- Cho thêm chất chống tạo bọt khi cần để có sự phân lớp tốt
2.4.4.2. Các phương pháp và kỹ thuật chiết
2.4.4.2.1. Phương pháp chiết lỏng-lỏng
- Nguyên tắc và điều kiện
Nguyên tắc: nguyên tắc của kỹ thuật chiết này là hai pha lỏng không trộn lẫn được vào nhau, trong hai dung môi này có thể có một dung môi chứa chất phân tích được để trong một dụng cụ chiết (phễu chiết). Khi lắc chiết, chất phân tích sẽ được phân bố vào hai dung môi theo tính chất của chúng để đạt tới trạng thái cân bằng. Vì thế hệ số nhiệt động KD của cân bằng chiết là yếu tố quyết định hiệu quả của sự chiết. Chiết theo kiểu này có hai phương pháp là chiết tĩnh và chiết theo dòng chay liên tục. Trong phân tích, phương pháp chiết tĩnh được sử dụng phổ biến hơn.
Điều kiện chiết: để quá trình chiết đạt hiệu quả tốt, phải có các điều kiện chiết như đã mô tả bên trên.
- Các phương pháp, trang bị và ví dụ
- Phương pháp chiết tĩnh: là phương pháo chiết rất đơn giản, chỉ cần một số phễu chiết dung tích 100-250 mL, có thể tiến hành được ở mọi phòng thí nghiệm. Việc lắc chiết có thể thực hiện bằng tay hay máy lắc nhỏ. Tất nhiên khi phải làm hàng loạt mẫu thì sẽ mất nhiều thời gian.
Ví dụ 1: Chiết lượng vết các ion kim loại nặng (Cd, Co, Cr, Cu, Fe, Ni, Pb, Zn) từ nước biển vào dung môi MIBK với thuốc thử tạo phức APDC trong môi trường pH 3-4 để xác định các nguyên tố này bằng phương pháp phổ hấp thu nguyên tử. Lấy 250 mL mẫu vào bình chiết, chỉnh pH 3-4 bằng HCl 10%, thêm 2 mL APDC 0.1% và 10 mL MIBK rồi lắc chiết trong 5 phút. Để yên 5 phút cho phân lớp, tách lấy phần MIBK có chứa phức kim loại Me-APDC. Sau đó xác định các kim loại đã chiết vào MIBK trực tiếp hay gián tiếp sau khi giải chiết kim loại vào dung dịch HNO3 2.5M. Phương pháp này thường được sử dụng để tách chiết và làm giàu lượng vết các kim loại trong các loại mẫu nước nhất là nước thải và nước biển.
Ví dụ 2: Chiết lấy tổng iodine-triiodide từ nước biển vào dung môi benzene trong sự hiện diện của chất oxy hóa mạnh và môi trường acid để chuyển iodide về iodine để được chiết vào benzene. Sau đó xác định nó bằng chuẩn độ thể tích hay bằng trắc quang. 200 mL mẫu + chỉnh pH=3 + 5 mL H2O2 + 10 mL benzene + lắc chiết 6 phút, để yên 5 phút cho phân lớp. Tách lấy lớp benzene chứa Iodine đi xác định.
Ví dụ 3: Chiết lấy các retinoid (vitamin A) từ mẫu thực phẩm
Loại mẫu thực phẩm có các dạng sau
+ Thực phẩm lỏng như sữa tươi. Lấy 10 mL mẫu vào bình chiết, thêm 20 mL ethanol tuyệt đối, 5-8 g Na2SO4khan, trộn đều 2 phút, thêm 10 mL dung môi hexane, lắc mạnh 4 phút, để trong tủ lạnh 2 hút cho tách lớp, lọc hút chân không, tách lấy lớp hexane có chứa các retinoid để phân tích chúng bằng HPLC hay MCEKC.
+ Các loại mẫu bột, rau quả, trứng thịt: nghiền hay xay thành bột, bảo quản ở -15oC. Lấy 5 g mẫu vào bình xử lý, thêm 15-20 g Na2SO4 khan, trộn đều, thêm 20 mL ethanol tuyệt đối, lắc mạnh 2 phút, thêm tiếp 10 mL hexane, lắc mạnh 4 phút, đặt trong tủ lạnh 4 phút cho phân lớp, lọc hút chân không, tách lấy lớp hexane có chứa các retinoid để phân tích chúng bằng HPLC hay MCEKC.
+ Mẫu huyết thanh: lấy 100 µL mẫu huyết thanh cho vào ống nghiệm, thêm 0.2 mL dung dịch NaCl 0.9%, 2 mL ethanol tuyệt đối, lắc mạnh 2 phút, thêm 0.5 mL dung môi n-hexane, lắc mạnh, ly tâm cho phân lớp, tách lấy lớp hexane có chứa retinoid để phân tích chúng bằng HPLC hay MCEKC.
Ví dụ 4: chiết α và β catotene từ các loại rau quả, lá cây
Trước hết mẫu được chọn và xay thành bột, bảo quản ở -15oC trong tủ đông. Lấy 5 g mẫu cho vào bình chiết, thêm 15 g Na2SO4 khan, 1 g MgCO3khan, trộn đều 2 phút, thêm 20 mL dung môi THF, khuấy đều trong 5 phút, lọc hút chân không, lấy pha THF chứa carotene vào bình cô quay chân không, cất cho đến còn khoảng 1 mL, để 1 phút cho khô, định mức thành 10 mL bằng THF. Đây là dung dịch để xác định α và β catotene bằng phương pháp HPLC.
- Phương pháp chiết dòng chảy liên tục
Trong phương pháp này khi thực hiện, chiết hai pha lỏng không trộn lẫn được vào nhau được bơm liên tục với một tốc độ nhất định qua một hệ chiết như phễu chiết hay bình chiết liên hoàn đóng kín. Hoặc cũng có thể chỉ một dung môi chuyển động còn một pha đứng yên. Khi đó chất phân tích sẽ được phân bố vào hai dung môi theo tính chất của chúng, để đạt tới trạng thái cân bằng. Vì thế ở đây hệ số phân bố nhiệt động KD là yếu tố quyết định hiệu quả chiết. Chiết theo cách này nhanh, hiệu suất cao, đây là phương pháp chiết được ứng dụng nhiều trong chiết sản xuất công nghệ.
Để thực hiện chiết theo cách này, phải có hệ thống máy chiết, cột chiết, có bơm để bơm các chất theo dòng chảy ngược chiều nhau và phải có bộ tách pha để tách các chất ngay trong quá trình chiết, để lấy chất được chiết ra liên tục hay theo từng thời điểm nhất định khi mà cân bằng đã đạt được.
Ví dụ: Chiết các kim loại nặng từ nước biển. Lấy V mL dung môi chiết thường (V≥ 25 mL tùy vào hàm lượng chất phân tích) cho vào bình chiết, thêm 2 mL APDC 0.1% trong EtOH, cho bình chiết vào hệ thống máy chiết, lắp hệ cho kín. Lấy 500 mL mẫu nước biển, chỉnh pH= 4 bằng HCl 10%. Bơm tuần hoàn liên tục dung dịch mẫu qua bình chiết trong 30 phút, sau đó tách lấy pha hữu cơ có chứa chất phân tích. Nếu không có hệ thống bơm thì có thể tiến hành chiết theo cách gia nhiệt bay hơi dung môi chiết.
- Ưu nhược điểm và phạm vi ứng dụng
Phương pháp chiết đơn giản, dễ thực hiện, đã được ứng dụng phổ biến và rất có hiệu quả trong lĩnh vực tách chiết và làm giàu các chất phân tích phục vụ cho việc xác định hàm lượng vết của chúng trong mẫu. Nhất là tách và làm giàu các kim loại, các chất hữu cơ độc hại trong các loại mẫu nước, nước thải, nước biển, nước khoáng. Các ưu và nhược điểm chung của kỹ thuật chiết là:
+ Thích hợp cho cả chiết phân tích và chiết điều chế lượng lớn
+ Loại được các chất ảnh hưởng, nhất là matrix mẫu
+ Thích hợp cho làm giàu lượng nhỏ chất phân tích
+ Phục vụ cho chiết các mẫu vô cơ và hữu cơ
2.4.4.2.2. Kỹ thuật chiết Soxhlet.
a. Nguyên tắc: chiết Soxhlet là một kỹ thuật chiết đặc biệt được thực hiện nhờ một loại thiết bị riêng của nó. Kiểu chiết này cũng như kiểu chiết lỏng-lỏng nên về bản chất của sự chiết vẫn là định luật phân bố của một chất trong hai pha không trộn lẫn vào nhau. Song ở đây hai pha không trộn lẫn vào nhau. Có thể pha mẫu ở trạng thái lỏng, bột, dạng mảnh hay lá. Dung môi chiết (hữu cơ) ở trong thái lỏng. Ví dụ chiết lấy dầu Meiton từ lá cây bạc hà bằng dung môi hữu cơ n-hexane hay benzene. Chiết các thuốc trừ sâu hay bảo vệ thực vật trong mẫu rau quả, mẫu đất bằng n-hexane. Vì thế đây là kiểu chiết của hệ chiết có thể cả đồng thể và dị thể. Trong thực tế, hệ dị thể là phổ biến và chất phân tích nằm trong matrix rắn.
b. Các trang thiết bị và ví dụ.
Trang bị của kỹ thuật chiết này có hai loại là
- Hệ chiết Soxhlet thường và đơn giản
- Hệ chiết Soxhlet tự động (auto-soxhlet)
Cách chiết theo hệ đầu tiên là đơn giản, vận hành bằng tay, còn hệ thứ 2 vận hành một cách tự động. Kỹ thuật này chủ yếu được sử dụng để tách các chất hữu cơ. Kỹ thuật này rất thích hợp để chiết chất phân tích nằm trong mẫu ở pha rắn như dạng bột, mảnh nhỏ hay các vật liệu khô như lá cây... Vì thế nó là hệ chiết dị thể. Kỹ thuật chiết này chủ yếu được sử dụng cho chiết tách phân tích các chất hữu cơ trong các đối tượng mẫu khác nhau không ở dạng lỏng.
- Ví dụ 1: Chiết soxhlet thường lấy một số hóa chất BVTV từ mẫu rau quả. Lấy 10 g mẫu đã được nghiền nhỏ và trộn đều vào cốc chiết của hệ chiết, thêm 25-30 g Na2SO4 khan, 30 mL dung môi chiết n-hexane có 20% CH2Cl2. Sau đó tiến hành chiết trong vòng 180 phút.
- Ví dụ 2: chiết auto-soxhlet lấy hóa chất BVTV từ mẫu đất. Lấy 10 g mẫu đã được nghiền nhỏ và trộn đều vào cốc chiết, thêm 25-30 g Na2SO4 khan, 30 mL dung môi chiết n-hexane có 20% CH2Cl2 (hay ethyl acetate). Sau đó tiến hành chiết trong vòng 150 phút, để yên 10 phút, tách lấy pha hữu cơ n-hexane có chứa chất phân tích và xác định chúng.
Kỹ thuật chiết này có ưu điểm là chiết triệt để, song các điều kiện chiết phải nghiêm ngặt thì mới có kết quả tốt. Vì thế hệ thống vận hành tự động cho kết quả tốt hơn nhưng phải có hệ thống trang bị hoàn chỉnh. Nó thích hợp chiết các chất hữu cơ từ các đối tượng mẫu khác nhau, chất phân tích có trong mẫu ở trạng thái rắn, bột, vật mẫu xốp khô (lá cây)... Kỹ thuật này được ứng dụng chủ yếu để chiết các hợp chất hữu cơ từ các mẫu cây, lá, rau quả hay mẫu đất như trong hai ví dụ trên.
2.4.4.2.3. Kỹ thuật chiết siêu âm
a. Nguyên tắc: quá trình chiết ở đây vẫn dựa trên cơ sở chung của sự chiết là sự phân bố của chất phân tích vào hai pha không trộn lẫn vào nhau, điểm khác biệt là được thực hiện chiết trong môi trường có thêm tác dụng của sóng siêu âm. Pha chứa mẫu phân tích là pha nước và pha lỏng để chứa chất phân tích là dung môi hữu cơ (pha thứ 2) đều được cho vào bình chiết, sau đó được đặt vào trong tủ chiết và tiến hành chiết dưới tác dụng của sóng siêu âm thích hợp. Cách chiết này có thể thực hiện ở hai trạng thái đồng thể và dị thể như:
- Hệ đồng thể lỏng lỏng, ở đây chất mẫu phân tích tan trong dung môi lỏng như nước và dung môi chiết cũng là chất lỏng, thường là các dung môi hữu cơ.
- Hệ dị thể rắn lỏng, trường hợp này mẫu phân tích ở trạng thái rắn thường được nghiền thành bột hay băm nhỏ và bỏ vào trong bình chiết có dung môi dung môi chiết thường là các dung môi hữu cơ.
Khi tiến hành chiết dưới tác dụng của sóng siêu âm có tần số cao, mạng cấu trúc của các phân tử chất mẫu bị phá vỡ, chất phân tích được giải phóng và phân bố (hay tan) vào trong dung môi chiết theo tính chất của nó và ở đây hệ phân bố của chất giữa hai pha cũng là yếu tố quyết định hiệu quả của sự chiết. Còn năng lượng siêu âm có tác dụng chính là phá vỡ cấu trúc ban đầu của mẫu, tạo điều kiện cho cân bằng chiết xảy ra dễ dàng hơn, triệt để hơn.
- Các kiểu chiết và trang bị
Để thực hiện theo kỹ thuật chiết này chúng ta phải có hệ thống bình chiết kín và hệ thống bình chiết tạo siêu âm. Các thiết bị này hiện nay đều đã được thương mại hóa theo từng quy mô và mức độ chiết khác nhau, chiết phân tích hay chiết điều chế sản xuất. Về nguyên tắc nó có hai bộ phận
- Buồng chiết siêu âm khống chế năng lượng siêu âm
- Các rotor chứa bình đựng mẫu để chiết (loại 6 bình, 9 bình hay 12 bình)
Sau đây là vài ví dụ.
- Ví dụ 1: Chiết các hợp chất Chlorphenol từ các mẫu nước bằng n-hexane: lấy 250 mL mẫu vào bình chiết, thêm 20 mL n-hexane, đậy nắp bình, vặn chặt, bỏ vào rotor chiết. Tiến hành chiết trong 20 phút, để yên 5 phút sau đó lấy bình mẫu ra khỏi rotor và tách lấy phần dung môi n-hexane, làm khô bằng Na2SO4 khan và xác định các chất chlorphenol trong pha n-hexane bằng HPLC hay GC-MS.
- Ví dụ 2: chiết các hydrocarbon thơm, đa vòng từ mẫu bã thải mía đường. Lấy 20 g mẫu đã nghiền nhỏ, trộn đều cho vào bình chiết, thêm 30 mL n-hexane chứa 20% dichloromethane (DCM), 25-30 g Na2SO4 khan, đậy nắp bình, vặn chặt, bỏ vào rotor chiết. Tiến hành chiết trong 20 phút, để yên 5 phút sau đó lấy bình mẫu ra khỏi rotor và tách lấy phần dung môi n-hexane, và xác định các chất cần phân tích trong pha n-hexane-DCM bằng HPLC hay GC-MS.
- Ví dụ 3: Chiết lấy một số hóa chất BVTV từ mẫu đất hay mẫu rau quả (như Methylparathion, sumithion, diazinon...). Lấy 20 g mẫu đất đã được nghiền nhỏ, trộn đều vào bình chiết, thêm 20 mL EtOAc, trộn đều, đặt bình vào hệ máy chiết, tiến hành chiết trong 40 phút, để nguội yên trong 10 phút, tách lấy pha hữu cơ có chứa các chất BVTV. Dội pha hữu cơ qua cột sắc ký hấp phụ chứa Al2O3-than hoạt tính-Na2SO4khan. Rửa giải cột này bằng 40 mL EtOAc. Dung dịch rửa giảo dùng để xác định các chất BVTV bằng GC, HPLC hay GCMS.
Kỹ thuật chiết này có ưu điểm là nhanh, triệt để và hiệu suất cao nhưng đòi hỏi phải có trang bị hệ thống chiết siêu âm hoàn chỉnh, có rotor chiết cho mỗi cách chiết khác nhau.
2.4.4.2.4. Kỹ thuật chiết pha rắn.
a.Nguyên tắc và điều kiện
- Nguyên tắc chung: nguyên tắc của quá trình chiết pha rắn là mẫu ở trạng thái lỏng hay hơi còn chất chiết ở dạng rắn, thể hạt nhỏ, xốp (5-10 µm đường kính). Chất chiết gọi là pha tĩnh và được nhồi vào cột sắc ký nhỏ (kích thước 10 x 1 cm hay dung lượng 5-10 mL). Chất chiết là các hạt silica trung tính, các hạt nhôm oxide hay silicagel đã alkyl hóa nhóm OH- bằng những nhóm alkyl mạch thẳng C2, C4, C8 hay C18... hay nhóm phenyl. Nó được chế tạo trong điều kiện tương tự như điều kiện chế tạo pha tĩnh của HPLC nhưng các hạt này có độ xốp lớn hơn và diện tích bề mặt xốp thường từ 50-200 m2/g. Khi xử lý mẫu, dung dịch chứa chất phân tích được dội lên cột có chứa pha rắn này. Pha tĩnh sẽ tương tác với các chất mẫu và giữ lại một nhóm chất phân tích, còn các nhóm khác sẽ đi ra khỏi cột cùng với dung môi hoa tan mẫu. Như thế nhóm chất phân tích tồn tại trên pha tĩnh và sẽ được rửa giải ra khỏi cột bằng một dung môi thích hợp. Các chất chiết pha rắn có thể được chế tạo theo các loại sau đây
+ Chất hấp phụ pha thường (silica trung tính và aluminium oxide)
+ Chất hấp phụ pha ngược (silica được alkyl hóa nhóm OH)
+ Chất có khả năng trao đổi ion (cationit, anionit, cặp ion)
+ Chất rây hay sàng lọc phân tử theo kích thước
+ Chất hấp phụ pha khí-rắn (purge and trap extraction)
Chính vì có nhiều loại pha tĩnh như thế nên kỹ thuật chiết pha rắn cũng có nhiều cơ chế và quá trình động học khác nhau, theo bản chất mỗi cơ chế đó. Sau đây là một số cơ chế và điều kiện chọn hệ chiết (pha tĩnh và pha động). Nói chung pha tĩnh trong chiết pha rắn cũng tương tự như pha tĩnh trong HPLC.
- Các điều kiện của chiết pha rắn
Quá trình chiết ở đây thực chất vẫn là quá trình phân bố của một chất trên hai pha tĩnh (pha rắn) và động (pha lỏng hay khí) trong những điều kiện nhất định về nhiệt độ, pH, tốc độ chảy dung môi qua cột chiết. Như vậy hệ số phân bố KDcủa một chất trên hai pha cũng là yếu tố quyết định hiệu quả của sự chiết. Tóm lại phải có các điều kiện sau đây
+ Pha tĩnh hấp phụ hay trao đổi chọnn lọc với một nhóm chất phân tích
+ Hệ số KD phải lớn
+ Quá trình chiết xảy ra nhanh, đạt cân bằng nhanh
+ Quá trình chiết phải có tính thuận nghịch cao để rửa giải thuận lợi
+ Sự chiết được thực hiện trong một điều kiện nhất định, càng đơn giản càng tốt.
- Các kiểu chiết và cơ chế chiết pha rắn
- Chiết theo cơ chế hấp phụ pha thường
Trong kiểu chiết này, pha rắn là các silica trung tính, có bề mặt phân cực. Nó áo dụng tốt với các chất mẫu không phân cực và ít phân cực. Đó là sự tương tác hấp phụ của pha tĩnh: chất chiết rắn trong cột. Tùy theo bản chất và cấu trúc phân tử mỗi nhóm chất phân tích và bản chất hấp phụ của silica trung tính và các điều kiện thực hiện sự tách mà nhóm chất phân tích nào bị pha tĩnh hấp phụ và bị giữ lại trên cột. Cơ chế của sự tương tác này hoàn toàn tương tự như cơ chế tương tác trong HPLC pha thường. Sau đây là minh họa của tương tác
Dung môi rửa giải chất phân tích trong loại này thường là các dung môi hữu cơ không hay ít phân cực và kỵ nước hoặc hỗn hợp của chúng theo tỷ lệ thích hợp. Ví dụ: n-hexane, n-heptane, CCl4, CHCl3, CH2Cl2, benzene... Các dung môi này được gọi là pha động và phải hòa tan tốt chất phân tích.
+ Ví dụ 1: Chiết để xử lý mẫu xác định nhóm hợp chất chlorophenol trong nước. Acid hóa 250 mL mẫu đến pH 2 bằng H2SO4 10%, sau đó dội mẫu này qua cột chiết loại LASi-5 tốc độ 4 mL/phút. Dội qua cột 10 mL nước cất, giải hấp bằng 40 mL acetonitril hay dichloromethane và xác định bằng HPLC hay GC.
+ Ví dụ 2: Chiết để xử lý mẫu xác định một số hydrocarbon thơm đa vòng (PAHs) hay một số pesticides trong nước thải. Acid hóa 250 mL mẫu bằng H2SO42% đến pH= 6, lọc bỏ cặn nếu có, dội dung dịch này qua cột loại SiOH với tốc độ 4 mL/phút. Giải hấp chất phân tích bằng ACN hay DCM. Xác định các chất phân tích bằng GC hay HPLC
- Chiết theo cơ chế hấp phụ pha ngược
Trong kiểu chiết này, pha tĩnh là Silica được alkyl hóa nên có bề mặt không phân cực. Nó tương hợp tốt với các chất không phân cực hay phân cực kém. Tương tác giữa chất phân tích với pha tĩnh và pha động tùy thuộc vào bản chất của chất phân tích (độ phân cực, kích thước, cấu trúc), pha tĩnh (độ phân cực, diện tích bề mặt riêng...) và pha động (độ phân cực, thành phần, tốc độ chảy...). Tương tác này tương tự với tương tác của pha tĩnh-pha động-chất tan gặp trong HPLC pha đảo. Dung môi rửa giải sử dụng trong kiểu chiết pha rắn pha đảo này là các dung môi có tính phân cực như nước, acetonitril, methanol, ethylacetate... Minh họa các tương tác pha tĩnh-pha động-chất tan như sau
+ Ví dụ 1: Chiết để xử lý mẫu xác định nhóm hợp chất chlorophenol trong nước. Acid hóa 250 mL mẫu đến pH 2 bằng HNO3 1N, ly tâm bỏ cặn, sau đó dội mẫu này qua cột chiết loại Baker-10 TPE-phenyl column, 6 mL No. 7095, tốc độ 3 mL/phút. Rửa cột bằng 10 mL HNO3 0.01N, giải hấp bằng 40 mL acetonitril và xác định bằng HPLC, GC hay GCMS.
+ Ví dụ 2: chiết để xử lý mẫu xác định nhóm các kim loại (Cd, Co, Cr, Cu, Fe, Ni, Pb, Zn) trong nước: thêm 1 mL thuốc thử Ultrex- 8-oxyquinolin vào 250 mL mẫu, chỉnh pH 8-9 bằng NH3 1N, lắc đều rồi dội mẫu qua cột Baker-10 C18SPE 5 mL với tốc độ 2-4 mL/phút. Rửa cột bằng 10 mL nước cất. Giải hấp các phức kim loại trên cột bằng 10 mL MeOH, xác định các nguyên tố trong pha MeOH bằng AAS. Để xác định kim loại, nên tro hóa ướt dịch chiết MeOH bằng HNO3. Có thể thay thuốc thử này bằng Na-diethyldithiocarbamate 0.1% trong EtOH.
+ Chiết để xử lý mẫu xác định một số thuốc BVTV trong nước. Lấy 250 mL mẫu nước, chỉnh pH 5, lọc bỏ cặn. Dội dung dịch qua cột chiết loại LR C18 với tốc độ 4 mL/phút. Rửa cột bằng 10 mL nước cất, hút chân không 5 phút. Rửa giải các chất BVTV trong cột bằng 20 mL EtOAc. Lấy dịch rửa giải này dội qua cột thứ 2 chứa Na2SO4-...-than hoạt tính, rửa giải bằng 10 mL EtOAc. Làm bay hơi dung dịch thu được bằng dòng khí Nitrogen đến khi dung dịch sánh, định mức thành 2 mL bằng EtOAc. Xác định các hóa chất BVTV bằng GC hay GCMS.
- Chiết theo cơ chế trao đổi ion và cặp ion.
Nguyên tắc: dựa trên cơ sở của quá trình tương tác của chất phân tích với ion đối (của chất trao đổi ion-pha tĩnh). Chất phân tích sẽ bị lưu giữ trên pha tĩnh và sẽ được rửa giải bằng một pha động thích hợp.
Chất trao đổi ion của kiểu chiết này có thể có hai loại sau
+ Trao đổi cation acid mạnh (gốc R-SO3Na) và acid yếu (R-COONa).
+ Trao đổi anion baz mạnh (gốc R-NR’3OH) và baz yếu (R-NHOH)
Cơ chế trao đổi loại cation:
Support-SO3Na + Men+ → support-(SO3)nMe + n Na+
Cơ chế trao đổi loại anion
Support-NR3OH + Xn- → support-(NR3)nX + nOH-
Trong quá trình trao đổi, tùy thuộc vào mỗi loại chất phân tích và pha tĩnh mà quá trình có thể được thực hiện tốt trong một khoảng pH nhất định nào đó.
Cùng với sự trao đổi anion và cation; trong sự chiết pha rắn còn có cơ chế chiết theo kiểu cặp ion (ion-pair). Nó cũng hoàn toàn tương tự như sắc ký cặp ion của hệ pha đảo (RP-HPLC). Pha tĩnh ở đây là chất trao đổi pha ngược.
Cơ chế trao đổi cặp cation
+ Ví dụ 1: Theo cơ chế trao đổi cation. Chiết tách các kim loại nặng (Cd, Co, Cr, Cu, Fe, Ni, Pb, Zn) trong mẫu nước khoáng, nước mỏ, nước thải… Acid hóa 250 mL mẫu nước đến pH 4, lọc bỏ cặn. Nạp mẫu vào cột chiết (chelex-100, dạng H+) với tốc độ 3-4 mL/phút. Giải chiết các kim loại trong cột bằng 10 mL HNO32.5M. Xác định chúng bằng AAS hay ICP.
+ Ví dụ 2: Theo cơ chế trao đổi anion. Chiết tách lấy các anion nhóm halogen, sulfate, nitrate… trong nước. Lấy 250 mL mẫu nước, chỉnh pH = 8, lọc bỏ cặn, dội qua cột chiết loại SPE.OH, 5 µm, 6 mL với tốc độ 2-4 mL/phút. Rửa giải chất phân tích bằng 10 mL NaOH 0.5M và xác định các anion Cl-, Br-, NO3-, sulfate… trong dung dịch này.
+ Ví dụ 3: theo cơ chế tạo cặp trao đổi cation. Chiết tách lấy các ion kim loại nặng trong nước thải bằng R-C18. Lấy 250 mL mẫu nước, chỉnh pH 5, lọc bỏ cặn, thêm chất tạo cặp ion rồi dội dung dịch mẫu qua cột chiết loại Hypersil ODS 5 µm, 6 mL, tốc độ 2-4 mL/phút, sau đó rửa giải chất cần phân tích bằng 10 mL dung dịch HIBA 0.25%, pH 4-5 hay EDTA, pH =5.
+ Ví dụ 4: theo cơ chế tạo cặp trao đổi anion: chiết tách các anion nhóm halogen, nitrate, sulfate … trong nước thải. Lấy 250 mL mẫu nước, chỉnh pH =8.5, lọc bỏ cặn, thêm chất tạo cặp ion rồi dội dung dịch mẫu qua cột chiết loại Hypersil R-NOH 5 µm, 6 mL, tốc độ 2-4 mL/phút, sau đó rửa giải chất cần phân tích bằng 10 mL dung dịch NaOH 0.2-0.3N.
- Chiết theo cơ chế sàng và rây phân tử
Nguyên tắc: chất chiết ở đây là các hạt silica (pha thuận hay pha đảo) có lỗ xốp lớn. Sự tách chiết theo kỹ thuật này dựa trên sự khác nhau về kích thước phân tử của chất phân tích khi mẫu được cho qua pha tĩnh trong cột chiết. Các phân tử kích thước nhỏ sẽ bị dồn ép vào phía sâu trong cùng của lỗ xốp, các phân tử kích thước lớn sẽ ở phía ngoài. Các phân tử có kích thước to hơn lỗ xốp sẽ nằm bên ngoài hạt pha tĩnh. Như vậy khi rửa giải, các phân tử to sẽ được rửa giải ra trước và tuần tự theo đó sẽ là các phân tử có kích thước nhỏ dần. Đây chính là cơ sở của sự tách chiết theo bằng kỹ thuật sàng và rây phân tử.
Các quá trình và ví dụ:
+ Ví dụ 1: chiết tách các nucleobazide trong mẫu dịch sinh học. Lấy V mL mẫu, nhũ hóa và đồng nhất bằng 50-100 mL hỗn hợp dung môi MeOH-ACN. Lắc kỹ và gạn lấy dịch trong, dội qua cột chiết Backer 10 SPE-P, 6 mL với tốc độ 3-4 mL/phút. Giải hấp chất phân tích bằng 20 mL DCM. Xác định bằng HPLC hay MKEC.
+ Ví dụ 2: chiết tách các chất của nhóm protein. Lấy V mL mẫu, nhũ hóa và đồng nhất bằng 50-100 mL hỗn hợp dung môi MeOH-ACN 8:2. Lắc kỹ và gạn lấy dịch trong, dội qua cột chiết Backer 10 SPE-P, 6 mL với tốc độ 3-4 mL/phút. Giải hấp chất phân tích bằng 20 mL DCM. Xác định bằng HPLC hay MKEC.
Ưu nhược điểm và phạm vi sử dụng chiết pha rắn
Chiết pha rắn là kỹ thuật chiết mới ra đời, đang phát triển và được ứng dụng trong khoảng vài chục năm trở lại đây nhất là ở các nước tiên tiến. Nhiều loại pha rắn và các dụng cụ chiết khác nhau đã được thương mại hóa. Các pha rắn thuờng dựa trên nền silica đã hoạt hóa, biến tính để tăng độ chọn lọc và dung lượng trao đổi. Kỹ thuật này có một số ưu nhược điểm sau
+ có tính chọn lọc với các hợp chất hữu cơ vì thế thích hợp cho phân tích vết
+ Thao tác đơn giản, nhanh hơn các kỹ thuật khác
+ Trong quá trình chiết có cả sự làm giàu chất phân tích.
2.4.4.5. Kỹ thuật chiết bẫy hấp phụ dạng khí (chiết rắn-khí)
2.4.4.5.1. Nguyên tắc chung
Kỹ thuật này dựa trên cơ sở là ở một nhiệt độ thích hợp, khi thổi một dòng khí trơ nóng (Ar hay He) vào dung dịch mẫu, một nhóm chất phân tích sẽ bị bay hơi và lôi cuốn theo dòng khí trơ đến cột hấp phụ, tại đây chất phân tích sẽ bị giữ lại trên pha tĩnh trong khi các chất khác đi qua. Vì thế về bản chất nó cũng là sự chiết giữa hai pha khí và rắn theo cơ chế hấp phụ. Để giải hấp, cột được gia nhiệt và chất phân tích bay ra khỏi bề mặt pha tĩnh và theo dòng khí trơ đi vào máy phân tích (GC) hay hấp thu vào một dung môi hữu cơ phù hợp cho các phép phân tích khác như HPLC hay UV-VIS. Phương pháp này được dùng cho các mẫu rắn và lỏng, bùn hay bã thải nhưng chỉ thích hợp cho các chất có nhiệt độ bay hơi thâp (< 150oC). Như thế tùy vào việc lựa chọn pha tĩnh và nhiệt độ mà người ta có thể tách được các nhóm chất ra khỏi nhau sau đó phân tích chúng theo các phương pháp phù hợp. Cách này rất thích hợp cho việc tách chiết các chất hữu cơ trong các mẫu rắn (bột, bùn, nhão). Tất nhiên việc trước tiên phải nhũ hóa các mẫu này bằng một dung môi thích hợp như nước hay một dung môi hữu cơ nặng có nhiệt đội sôi cao. Pha tĩnh thường là các chất hấp phụ dựa trên silica như silica trung tính hay biến tính tương tự như các hệ NP-HPLC, RP-HPLC.
2.4.4.5.2. Các kiểu chiết, trang thiết bị và ví dụ
Theo kỹ thuật này trang thiết bị cũng có hai loại là hệ đơn giản và hệ hoàn chỉnh, tự động được theo chương trình định sẵn. Khí mang sử dụng là Ar, He hay N2tinh khiết > 99.9%.
Ví dụ 1: chiết một số hydrocarbon dễ bay hơi trong các loại nước hay mẫu rắn: cột hấp phụ là pha rắn DSC 25x1 cm (DSC: diphenylene oxide polymer-silicagel-coconut charcoal 1:1:1), mẫu được giữ trong bình cầu và dòng Ar thổi qua bình mẫu với tốc độ 0.8-1.0 mL/phút để đưa chất phân tích vào cột hấp phụ. Các chất hữu cơ benzene, bromobenzene, bromomethane, bromoethane, chloromethane, chloroethane, ethylbenzene… sẽ được hấp phụ vào cột này. Việc giải hấp được tiến hành bằng dòng khí trơ Ar gia nhiệt ở 180oC và dẫn trực tiếp vào máy GC, GCMS hay vào một dung môi phù hợp như n-hexane dùng để xác định bằng một phương pháp khác.
+ Ví dụ 2: chiết lấy một số hợp chất pesticides dễ bay hơi trong các loại nước hay mẫu rắn, bùn (method 502,2b). Cột hấp phụ là pha rắn LC2 25x1 cm. Mẫu được giữ lở 150oC và dòng khí Ar thổi qua mẫu với tốc độ 0.8-1 mL/phút để chuyển chất phân tích vào cột hấp phụ. Giải hấp các chất hấp phụ bằng dòng Ar ở nhiệt độ 200oC trực tiếp vào máy GC hay GCMS.
Kỹ thuật này rất thích hợp cho việc xử lý các loại mẫu để xác định các chất hữu cơ có nhiệt độ sôi < 200oC và dễ bay hơi trong các loại mẫu rắn, bùn, bã thải. Nó có ưu điểm là chọn lọc cho mỗi nhóm chất tùy vào chất phấp phụ, thích hợp cho các phương pháp phân tích HPLC, GC, GCMS nên được sử dụng chủ yếu cho phân tích vi lượng các chất hữu cơ trong các loại mẫu khác nhau.
2.4.5. Kỹ thuật chưng cất
2.4.5.1. Nguyên tắc chung:chưng cất là kỹ thuật tách dựa trên sự khác biệt về điểm sôi của các chất theo đó có thể lấy được một chất hay một nhóm chất dựa vào mức độ sai biệt về nhiệt độ sôi, trang thiết bị và điều kiện (nhiệt độ) chưng cất. Có nhiều kiểu chưng cất khác nhau như:
- Chưng cất thông thường
- Chưng cất lôi cuốn hơi nước
- Chưng cất áp suất thấp (cô quay chân không).
2.4.5.2. Các kiểu và phương pháp chưng cất
2.4.5.2.1. Chưng cất thông thường
- Nguyên tắc: đây là quá trình chưng cất các chất chỉ đơn thuần dựa vào điểm sôi của các chất để tách chúng theo từng phân đoạn trong những điều kiện bình thường. Khi chưng cất, các chất có nhiệt độ sôi khác nhau sẽ ngưng tụ lại tại những phân đoạn khác nhau.
- Cách thực hiện và ví dụ:
- Ví dụ 1: chưng cất để lấy MeOH tinh khiết từ MeOH bẩn. MeOH có nhiệt độ sôi là 64.5oC nên sẽ chưng cất được MeOH tinh khiết nếu thu dịch chưng cất tại phân đoạn có nhiệt độ này.
- Ví dụ 2: Chưng cất lấy acetone từ hỗn hợp acetone và MeOH bẩn. Aceton có nhiệt độ sôi là 56.5oC nên khi chưng cất chúng ta chỉ lấy phân đoạn tại nhiệt độ này.
- Ví dụ 3: chưng cầt mẫu xác định hàm lượng NH4+. Lấy 10 g mẫu đã nghiền mịn cho vào bình chưng cất, thêm 100 mL NaOH 10%, lắc đều, đun sôi nhẹ, thổi một dòng N2 sạch qua bình chưng cất, dẫn hơn NH3 sinh ra sang bình hấp thu là dung dịch H2SO40.1 N. Chuẩn độ lượng acid dư, chúng ta sẽ tính được hàm lượng NH4+hay N trong mẫu.
2.4.5.2.2. Chưng cất lôi cuốn hơi nuớc.
Nguyên tắc: Đây là quá trình chưng cất tinh chế và tách các chất cũng dựa vào điểm sôi của chúng để tách các chất theo từng phân đoạn trong những điều kiện nhất định theo nhiệt độ sôi và bay hơi khi chưng cất. Tuy nhiên trong trường hợp này chất phân tích cần chưng cất không bay hơi một mình mà phải có một chất khác có nhiệt độ sôi gần hay bằng chúng để lôi cuốn chúng theo. Sản phẩm lôi cuốn là một dung dịch hỗn hợp có hòa tan chất cần phân tích. Ví dụ để cất lấy cresol,formaldehyde; người ta phải chưng cất lôi cuốn nó cùng với hơi nước, sau đó mới xác định chúng từ dung dịch này hay tách chúng ta khỏi nước bằng cách chiết lỏng-lỏng hay chiết lỏng-rắn trước khi phân tích.
Các cách thực hiện và ví dụ.
- Ví dụ 1: chưng cất bằng lôi cuốn hơi nuớc lấy formaldehyde từ bánh phở, bún… Lấy 20 g vào cối mã não, thêm 20 mL nước cất, nghiền mịn, trộn đều, cho vào bình chưng cất, tráng cối bằng 20 mL nước cất, thêm 60 mL nước cất nữa (cho đủ 100 mL), lắc đều, lắp ống sinh hàn và chưng cất từ từ trong 30-40 phút, thu được 50 mL dịch chưng cất. Dung dịch cất này dùng để xác định formaldehyde bằng phổ UV-VIS hay HPLC hay GCMS.
- Ví dụ 2: chưng cất lấy tinh dầu bạc hà nhờ lôi cuốn hơi nước. Lá bạc hà được cắt nhỏ, cho vào bình chưng cất, thêm nước cho ngập lá (1 kg là, 1.5 L nước). Chưng cất cho đến khi thu được 60% dung dịch thì dùng. Dùng phương pháp chiết lỏng lỏng để tách tinh dầu ra khỏi nước vào dung môi hữu cơ. Cách này có thể vừa được dùng cho mục đích phân tích vừa được dùng cho mục đích điều chế sản xuất.
2.4.5.2.3. Chưng cất ở áp suất thấp- cô quay chân không
a. Nguyên tắc chung: Đây là quá trình chưng cất để tinh chế các chất dựa theo điểm sôi của chúng mà tách các chất theo từng phân đoạn trong những điều kiện nhiệt độ nhất định ở áp suất thấp (khống chế bằng bơm chân không) nhằm tách các hợp chất kém bền nhiệt. Trong điều kiện này nhiệt độ hóa hơi của chất phân tích sẽ hạ thấp, quá trình chưng cất sẽ nhanh hơn mà lại có hiệu quả tách tốt hơn. Khác với điều kiện thông thuờng, ở áp suất thấpcác chất sẽ có nhiệt độ sôi và bay hơi khác nhau vì thế sau chưng cất phải thử lại từng phân đoạn xem chất phân tích hiện diện ở đâu. ???
b. Trang bị và cách thực hiện: Để xử lý theo kỹ thuật này, phải trang bị hệ thống máy cô quay và máy bơm chân không để điều chỉnh nhiệt độ và áp suất thấp thích hợp. Sau đây là một vài ví dụ.
- Ví dụ 1: chưng cất làm bay n-hexane để lấy chất phân tích nhóm Vitamin A và Caroten bằng cất quay chân không. Lấy 10 g mẫu đã nghiền nhỏ vào phễu chiết, thêm 20 g Na2SO4khan, 100 mL dung môi THF hay n-hexane. Lắc kỹ trong 10 phút, lọc qua phễu Busner, lấy dung dịch cho vào và cho vào bình cất của máy cô quay để cất cho dung môi bay hơi đến khi còn bã ẩm, để nguội. Hòa tan bã này trong 5 mL MeOH, dung dịch này dùng để xác định Caroten bằng HPLC.
- Ví dụ 2: Chưng cất tách MeOH tinh khiết từ MeOH kỹ thuật (nguyên liệu thô) và thu lấy bã còn lại để xác định một số tạp chất có trong MeOH kỹ thuật. Lấy 200 mL MeOH vào bình chưng cất, lắp hệ thống cô quay chân không và chưng cất MeOH cho đến khi dịch lỏng trong bình chưng cất còn khoảng 2 mL, để nguội. Lấy bã này hòa tan trong 5 mL DCM, ly tâm hay lọc tách bỏ cặn. Xác định các tạp chất hữu cơ trong dịch lọc bằng GC, GCMS hay HPLC.
2.4.6. Kỹ thuật lên men mẫu
2.4.6.1. Nguyên tắc và đặc điểm
Chuyển hay hòa tan mẫu vào trong nước thành dung dịch hay thể huyền phù, thêm 10-15 mg men xúc tác, và chỉnh môi trường bằng acid hay kiềm, hay muối acetate cho phù hợp (pH= 7-8), rồi đưa mẫu vào buồng để lên men ở nhiệt độ từ 37- 40oC cho đến khi mẫu trong hoàn toàn, tức là các kim loại chuyển vào dung dịch. Thời gian lên men từ 7-10 ngày. Kiểu này rất thích hợp cho phân tích xác định các kim loại trong các mẫu đường mía, nước ngọt giải khát, bia, rượu, các mẫu nước quả chín, cam, chanh...
Kỹ thuật này có các ưu nhược điểm và đặc điểm như sau:
+ Kỹ thuật đơn giản, dễ thực hiện
+ Không tốn kém hóa chất nhưng cần tủ ấm điều chỉnh được nhiệt độ
+ Mất thời gian
+ Chỉ áp dụng được cho một số loại mẫu
+ Kỹ thuật này được dùng chủ yếu là để xác định các kim loại trong mẫu dạng lỏng như nước ngọt giải khát, các loại nước quả, đường hay dung dịch đường.
2.4.6.2. Các phương pháp và ví dụ:
- Ví dụ 1: Xác định lượng vết kim loại nặng trong đường vàng hoa mơ, nước ngọt. Hòa tan 5 g đường vào 80 mL nước cất, chỉnh pH =7-8, đun nóng đến 40oC, thêm men xúc tác, đậy kính đồng hồ, để trong tủ ấm duy trì ở 37- 40oC cho lên men trong 7 ngày. Thêm 10 mL HCl 35%, đun sôi, ly tâm lấy dịch trong, làm bay hơi còn muối ẩm. Định mức thành 25 mL bằng HCl 2%, xác định kim loại nặng trong dung dịch này.
2.4.7. Phương pháp pha loãng bằng dung môi thích hợp.
2.4.7.1. Nguyên tắc và đặc điểm
Nguyên tắc: chọn một dung môi thích hợp hòa tan tốt chất mẫu để pha loãng nó theo một tỷ lệ nhất định sau đó phân tích bằng một phương pháp đã chọn. Ví dụ phân tích các kim loại kiềm thổ trong dầu nhớt. Pha loãng mẫu 20 lần bằng dung môi MIBK, xác định bằng AAS hay ICP-AES.
Các làm này khá đơn giản, dễ thực hiện và không cần trang thiết bị phức tạp nhưng lại chỉ thích hợp cho một số trường hợp hạn chế như hàm lượng chất phân tích trong mẫu đủ lớn để có thể vẫn xác định được khi pha loãng. Quá trình pha loãng sẽ giảm thiểu các yếu tố ảnh hưởng đến chất phân tích nhu thành phần nền, độ nhớt, cặn không tan...
2.4.7.2. Cách thực hiện và ví dụ
- Ví dụ 1: Xác định các kim loại kiềm thổ (Ca, Ba, Sr) trong dầu bôi trơn hay dầu nhờn. Pha loãng mẫu 20 lần bằng MIBK, ly tâm bỏ cặn. Dịch lọc đem xác định bằng FAAS hay ICP-AES.
Có thể pha loãng mẫu bằng CCl4 và xác định bằng GFAAS.
-Ví dụ 2: Xác định các hydrocarbon thơm trong dầu mỏ. Pha loãng mẫu dầu 25 lần bằng n-hexane và DCM. Lắc đều, ly tâm lấy dịch trong. Xác định bằng GC hay GCMS.
- Ví dụ 3: pha loãng mẫu huyết thanh bằng nước cất để xác định kim loại K, Na, Ca, Mg.
+Xác định K, Na: lấy 0.2 mL huyết thanh pha loãng bằng nước cất thành 20 mL.
+ Xác định Ca, Mg: lấy 0.2 mL huyết thanh pha loãng bằng nước cất thành 10 mL.
+ Xác định Cu, Zn: lấy 0.25 mL huyết thanh pha loãng bằng nước cất thành 1 mL.
2.4.8. Kỹ thuật thăng hoa lấy mẫu phân tích.
2.4.8.1. Nguyên tắc chung: dựa trên cơ sở tính chất hay đặc điểm của chất phân tích có khả năng thăng hoa trong một điều kiện nhất định khi xử lý mẫu để tách nó ra khỏi matrix. Ví dụ kim loại Hg, Ga.. ra khỏi mẫu đất đá, quặng hay bã thải rắn.
2.4.8.2. Trang bị, cách xử lý và ví dụ.
Các trang bị phục vụ cho kiểu thăng hoa cũng có nhiều loại khác nhau, từ đơn giản tới hoàn chỉnh và tự động theo chương trình.
- Ví dụ: thăng hoa lấy Hg trong mẫu quặng. Cho 1 g mẫu quặng nghiền mịn vào trong bình hai bầu hay cốc thăng hoa. Thêm 0.6 g Fe kim loại, 1 g CaO khan, lắc nhẹ cho đồng nhất. Làm lạnh phần ống thạch anh đến 10oC bằng bộ điều nhiệt, nước đá hay tuyết carbonic và đốt nóng bầu chứa mẫu trên đèn khí, quay đều bình mẫu để Hg thăng hoa cho đến khi hỗn hợp mẫu trong bình có màu đỏ sẫm. Đốt thêm 2 phút nữa. Khi thăng hoa, Hg sẽ bám vào ống thạch anh đã được làm lạnh hay đáy bình ngưng tạo thành một lớp sáng bóng. Đập bỏ bầu chứa mẫu bên dưới, lấy phần ống thạch anh có Hg bám vào, hòa tan Hg trong HNO31:1 nóng ở 80oC, lắc đều, để yên 30 phút, thu dung dịch này và thêm 0.1 mL K2Cr2O7 1%, định mức thành 25 mL hay 50 mL. Dung dịch này dùng để xác định Hg bằng phương pháp phổ hấp thu nguyên tử hóa hơi lạnh.
- Cách này có thể được dùng thể xử lý các loại mẫu đất đá, quặng, rác thải rắn, bùn,cát... để xác định Hg hay Ga hay các hợp chất cơ kim dễ bay hơi.
2.4.9. Kỹ thuật chlor hóa mẫu.
2.4.9.1. Nguyên tắc: Nguyên tắc của kỹ thuật này là sục một dòng khí chlorine qua mẫu đun nóng. Mẫu thường được nghiền nhỏ dạng nhũ hóa trong nước hay acid loãng. Ở nhiệt độ và áp suất thích hợp, các kim loại trong mẫu sẽ tương tác với khí chlorine và chuyển về các muối chloride tan trong dung dịch. Hòa tan mẫu vào acid loãng để tách các chất phân tích ở dạng muốn tan.
2.4.9.2. Trang bị, cách tiến hành và ví dụ
Hệ thống chlor hóa mẫu gồm các bộ phận
- Buồng chứa mẫu để chlor hóa
- Hệ điều chế khí chlorine, hệ thống điều khiển tốc độ và dẫn khí chlorine mới sinh vào buồng chứa mẫu
- Hệ thống hòa tan muối thu được sau khi chlor hóa
- Hệ thống điều khiển nhiệt độ cho bình mẫu và bộ ngưng tụ hơi mẫu thăng hoa
Ví dụ: Chlor hóa quặng đất hiếm để lấy các nguyên tố đất hiếm ở trạng thái muối chloride tan trong dung dịch nước. Lấy 5 g mẫu đã nghiền nhỏ vào bình chlor hóa, thêm 50 mL nước cất, lắc đều, acid hóa đến pH 1 bằng HCl 5%, lắc kỹ, đun sôi hỗn hợp, đặt trên nồi cách thủy hay bếp điều nhiệt, dẫn khí chlor mới sinh với tốc độ 0.8 mL/phút vào bình mẫu. Duy trì phản ứng trong 30 phút, để nguội, thêm 10 mL HCl 10%, đun sôi và lọc lấy dung dịch mẫu. Đây là dung dịch chứa muối chloride các nguyên tố đất hiếm có trong quặng.
2.4.10. Kết tủa hay hóa lỏng ở nhiệt độ thấp
2.4.10.1. Nguyên tắc chung: chọn điều kiện thích hợp và trong một dung môi để kết tủa phân đoạn chất phân tích dưới dạng một hợp chất không tan, sau đó tách chúng ta khỏi hỗn hợp mẫu và xử lý kết tủa theo cách phù hợp với phương pháp phân tích lựa chọn. Phương pháp này giúp tách đồng thời cũng làm giàu chất phân tích.
2.4.10.2. Cách tiến hành
- Ví dụ 1: kết tinh lấy các halides từ môi trường không khí. Dung dịch AgNO3/HNO3 làm lạnh đến 10oC được sử dụng để hấp thu chất phân tích dưới dạng các kết tủa AgX. Mẫu không khí được bơm sục qua dung dịch hấp thu ở tốc độ 1-2 L/phút đến khi được 250 L không khí. Ly tâm lấy kết tủa để xác định halides theo các phương pháp đã biết.
- Ví dụ 2: tách và làm giàu để xác định một số kim loại nặng trong mẫu nước. Lấy 250 mL mẫu nước vào bình kết tủa, chỉnh pH =2 bằng HCl 5%, lọc bỏ cặn nếu có, cô cạn còn 100 mL, thêm 0.5 g NH4NO3, 1 mL FeCl3, lắc đều cho tan hết, đun sôi, cho khí H2S sục vào với tốc độ 3 bóng khí/ giây trong 20 phút, khuấy đều dung dịch khi sục khí, để nguội đến nhiệt độ phòng, khuấy mạnh và đặt cốc trong chậu nước đá 5 phút, lọc kết tủa sulfide qua giấy lọc băng xanh, rửa kết tủa 2 lần bằng 20 mL NH4NO30.1% ở pH= 6. Lấy kết tủa hòa tan trong HNO3 45% nóng, đun cho tan hết và làm bay hơi hết acid đến còn muối ẩm. Định mức đến 25 mL bằng HCl 2%. Dung dịch này có thể dùng để xác định kim loại nặng bằng phương pháp trắc quang, AAS hay AES.
- Ví dụ 3: Hạ nhiệt độ để kết tinh các chất phân tích hữu cơ. Nói chung các chất hữu cơ trong điều kiện thường nếu tồn tại ở trạng thái khí thì có thể dùng được phương pháp này. Ví dụ như khí methane, ethane, propane, butane... Phương pháp này chủ yếu dùng trong công nghệ mà ít dùng trong phòng thí nghiệm vì các hệ trang thiết bị khá đắt tiền.
2.4.11. Kỹ thuật điện phân
2.4.11.1. Nguyên tắc và đặc điểm: Trong một bình điện phân, nếu áp một điện thế 1 chiều nhất định lên hai điện cực, nhiều chất, chủ yếu là các ion kim loại sẽ chạy vào điện cực âm, nhận điện tử để trở thành nguyên tử trung hòa và bám lên bề mặt điện cực. Có thể dùng phương pháp khối lượng để xác định các chất bám trên điện cực hay hòa tan chất trên điện cực rồi xác định nó bằng phương pháp phù hợp. Một trong các phương pháp loại này là phương pháp Volt-Ampere hòa tan.
Các đặc điểm:
- Tách được chất phân tích ra khỏi hỗn hợp mẫu
- Làm giàu được chất phân tích từ mẫu có nồng độ rất loãng, không thể xác định trực tiếp
- Cần phân bố hệ trang thiết bị điện phân và phương pháp này chỉ giới hạn cho một số ion kim loại trong mẫu môi trường dung dịch nước.
2.4.11.2. Các trang thiết bị, cách thực hiện và ví dụ
Hệ thiết bị điện phân bao gồm
- Bình điện phân và hệ điện cực (anode và cathode). Điện cực âm (cathode) để điện phân cho các kim loại kết tủa lên thường là các điện cực dạng lưới hay thanh dẹp, được làm từ các điện cực trơ và bền hóa học như Pt, Au, Pd, W...
- Nguồn cấp thế một chiều có thể điều chỉnh được theo yêu cầu điện phân của mỗi chất điện phân khác nhau.
- Hệ thống điều khiển và kiểm tra quá trình điện phân.
- Ví dụ: Điện phân tách Cu khỏi dung dịch trong mẫu nước khoáng. Để điện phân, người ta dùng điện cực âm bằng mành hay lưới bằng Pt. Quá trình điện phân được thực hiện với ion Cu(II) trong môi trường acid HCl loãng (0.2M) ở thế một chiều -0.5V. Sau đó hòa tan kim loại Cu kết tủa trên cực Pt bằng HNO3loãng. Xác định Cu theo các phương pháp đã biết tùy theo hàm lượng của nó.
-
2.4.12. Các phương pháp sắc ký
Sắc ký là một loại phương pháp tách để xác định đồng thời các chất trong một hỗn hợp và nó cũng là một phương pháp xử lý mẫu tốt cho nhiều trường hợp để tách lấy các chất cần phân tích. Trong ứng dụng để xử lý mẫu chủ yếu là sắc ký cột và sắc ký bản mỏng.
2.4.12.1. Phương pháp sắc ký cột
- Nguyên tắc và điều kiện
Nguyên tắc: Phương pháp xử lý mẫu này dựa trên cơ sở tính chất hấp phụ hay phân bố hay trao đổi của các chất để lưu giữ chất phân tích lên pha tĩnh ở trong cột sắc ký, để tách chúng ra khỏi mẫu ban đầu. Sau đó dùng một dung môi thích hợp (pha động) để rửa giải và hòa tan chúng vào pha động để tách nó ra khỏi cột sắc ký rồi xác định chúng trong pha động này bằng một phương pháp phù hợp. Ví dụ như AES, AAS, UV-VIS, HPLC, GC, EC...Vì thế trước hết phải đưa mẫu phân tích về dạng dung dịch để có thể nạp vào cột sắc ký. Sự tách sắc ký ở đây là dựa trên hai pha không trộn vào nhau, pha tĩnh là chất rắn, pha động là chất lỏng (dung môi rửa giải). Vì thế nó cũng tương tự như kỹ thuật chiết pha rắn. Chủ yếu ở đây là sắc ký hấp phụ dùng pha tĩnh là silicagel hay aluminium oxide xốp có tính chất sắc ký để tách các nhóm chất.
Điều kiện:
- Chọn pha tĩnh có tính chất chọn lọc cho một nhóm chất phân tích
- Chọn pha động phù hợp cho chất cần xử lý để thu được nó tốt nhất
- Cân bằng trong quá trình sắc ký phải có tính chọn lọc tốt
- Chọn điều kiện sắc ký thích hợp để góp được chất phân tích vào một nhóm hay tách từng chất thì càng tốt.
- Trang bị, cách xử lý và ví dụ
Muốn thực hiện chiết kiểu này chúng ta phải có các hệ sắc ký phù hợp. Có thể chỉ là các cột tách đơn giản, và cũng có thể là các hệ thống tự động hoàn chỉnh. Nó bao gồm trước hết là cột sắc ký chứa pha tĩnh như silicagel hay aluminium oxide xốp có khả năng hấp phụ hay trao đổi ion với một hay một nhóm chất phân tích. Thứ hai là các dung môi để hòa tan mẫu phân tích và dung môi rửa giải chất phân tích ra khỏi cột sắc ký. Tùy loại chất phân tích mà chúng ta có thể chọn hệ pha sắc ký hấp phụ hay hệ pha trao đổi ion để tách chất phân tích.
- Ví dụ 1: Xử lý mẫu xác định các alkaloid. Hòa tan mẫu và chuyển mẫu về dạng lỏng trong một dung môi hữu cơ thích hợp, ví dụ như n-hexane hay acetonitril... Sau đó lấy cả dung dịch này hay chỉ 1 thể tích nhỏ nhất định nạp vào cột sắc ký hấp phụ có pha tĩnh là aluminium oxide với tốc độ chảy 1 mL/phút để chất phân tích được pha tĩnh hấp phụ và giữ lại. Sau đó dùng n-hexane hay hỗn hợp n-hexane+DCM, tỷ lệ 1:1, để rửa giải chất phân tích ra khỏi cột sắc ký với tốc độ 1.5 mL/phút. Như vậy chất phân tích sẽ được rửa giải và tan vào pha động rửa giải, và tiến hành xác định nó trong pha động rửa giải này bằng một trong các phương pháp như HPLC, GC, CEC...
- Ví dụ 2: Xử lý mẫu để xác định các chlorophenol trong mẫu đất. Hòa tan và chuyển mẫu về dạng lỏng trong một dung môi thích hợp ví dụ THF, lọc lấy dung dịch THF, làm khô bằng muối Na2SO4 khan. Lấy dung dịch hữu cơ này nạp vào cột sắc ký hấp phụ có pha tĩnh là pha ngược C18 với tốc độ chảy là 1 mL/phút để chất phân tích được pha tĩnh lưu giữ. Sau đó dùng 10 mL pha động (ACN-THF) để rửa giải chất phân tích ra khỏi cột sắc ký với tốc độ chảy là 1.5 mL/phút. Như vậy chất phân tích sẽ tan vào pha động này và xác định nó trong pha động thu được bằg một trong các phương pháp như HPLC, GC, CEC...
- Ví dụ 3: Xử lý mẫu để xác định lượng vết kim loại nặng trong nước biển. Lấy 250 mL mẫu, chỉnh pH =5, lọc bỏ cặn, sau đó nạp lên cột sắc ký trao đổi loại DOWEX-50X12-Na (150 x 8mm) với tốc độ chảy 1 mL/phút để các ion kim loại được giữ lại trên cột sắc ký. Khi mẫu chảy hết, dội qua cột 5 mL nước cất hai lần. Sau đó dùng 20 mL dung dịch HNO3 3M để rửa giải chất phân tích ra khỏi cột sắc ký với tốc độ 1.5 mL/phút. Như vậy chất phân tích sẽ tan vào dung môi rửa giải và có thể được xác định bằng phương pháp phân tích phù hợp như AAS, AES, UV-VIS. Cách này có thể dùng cách xử lý mẫu cho việc xác định các kim loại trong các loại nước mặt, nước thải...
- Ví dụ 4: Xử lý mẫu để xác định một số anion trong mẫu nước (halides, nitrate, sulfate...). Lấy 250 mL mẫu, chỉnh pH =7.5-8, lọc bỏ cặn, sau đó nạp lên cột sắc ký trao đổi loại DOWEX-50A12-OH (150 x 8mm) với tốc độ chảy 1 mL/phút để các ion kim loại được giữ lại trên cột sắc ký. Khi mẫu chảy hết, dội qua cột 5 mL nước cất hai lần. Sau đó dùng 20 mL dung dịch NaOH 1M để rửa giải chất phân tích ra khỏi cột sắc ký với tốc độ 1.5 mL/phút. Như vậy chất phân tích sẽ tan vào dung môi rửa giải và có thể được xác định bằng phương pháp phân tích phù hợp UV-VIS hay sắc ký ion.... Cách này có thể dùng cách xử lý mẫu cho việc xác định các kim loại trong các loại nước mặt, nước thải...
2.4.12.2. Sắc ký giấy và sắc ký bản mỏng
- Nguyên tắc chung: quá trình sắc ký ở đây là dựa trên cơ sở là trong hệ dung môi nhất định thì sự phân bố hấp phụ của các chất trên nền silicagel xốp được tráng trên bản thủy tinh hay polymer cứng hay sự hấp phụ của các chất trên bản giấy xốp sắc ký khác nhau. Trong quá trình sắc ký, các chất sẽ di chuyển khác nhau tạo ra mỗi chất có một vùng riêng trên bản mỏng và tách ra khỏi nhau. Vì thế mới có tên là sắc ký bản mỏng và sắc ký giấy.
- Các trang bị, cách tiến hành và ví dụ
Muốn thực hiện tách chiết theo kiểu này chúng ta phải có các trang bị sắc ký. Nó bao gồm:
- Các loại bản mỏng sắc ký là các chất silicagel hay aluminium oxide xốp có khả năng hấp phụ các chất phân tích.
- Các hệ dung môi để hòa tan mẫu phân tích
- Các bình chạy sắc ký và dung môi để chạy sắc ký
- Pha động chạy sắc ký
Tùy loại chất phân tích, mà chúng ta có thể chọn hệ pha sắc ký giấy hay sắc ký bản mỏng. Bản mỏng hay giấy sau khi chấm lên được làm khô và ngâm vào dung môi trong bình sắc ký. Lúc này các chất phân tích sẽ chạy theo dung môi từ dưới lên trên và tạo thành từng vùng chất. Sau khi chạy sắc ký, tách các vùng mẫu để xác định các chất hay xác định bằng các phương pháp phổ phân tử (hấp thu hay phản xạ).
- Ví dụ 1: tách một số alkaloid từ củ bình vôi bằng sắc ký bản mỏng. Lấy 10 g mẫu đã nghiền mịn và bình nón, thêm 20-25 g Na2SO4khan, thêm 40 mL n-hexane, lắc mạnh 10 phút, để lắng, lọc hứng lấy dung dịch. Làm bay hơi dung môi bằng dòng khí nitrogen sạch cho đến khi còn bã ẩm. Hòa tan bã này trong 2 mL DCM và lấy dung dịch mẫu này chạy sắc ký bản mỏng (loại MA-450) trong hệ dung môi A (30% n-hexane+10%THF+10%DCM+pH=6) để tách lấy các alkaloid, sau đó lấy bản mỏng, tách lấy vùng chất, hòa tan nó trong một dung môi thích hợp như DCM và xác định chúng. Hay hệ dung môi khác thích hợp.
- Ví dụ 2: Tách lấy hợp chất carotene từ mẫu rau quả bằng sắc ký bản mỏng. Lấy 10 g mẫu đã nghiền nhỏ và bình chiết, thêm 25 g Na2SO4 khan, 40 mL THF, lắc chiết 10 phút, lọc lấy dung dịch THF, cất quay chân không cho đến còn bã, hòa tan bã này trong 5 mL n-hexane. Lấy dung dịch mẫu này chạy sắc ký lớp mỏng trên bản silica (loại Si-MA 560).
Sơ đồ chung phân tích kim loại
So sánh kết quả tro hóa ướt và khô
| Ng tố | CX | Cách tro hóa | Phụ gia bảo vệ | Nhiệt độ (oC) | Recovery (%) |
| Pb | 10 | Ướt: HNO3+HClO4 HNO3+HClO4+H2SO4 HNO3+H2SO4 Khô | Không H2SO4 HNO3 Mg(NO3)2 Mg(OAc)2 | 450 550 650 450 550 650 450 550 650 450 550 650 450 550 650 | 97-100 93-98 90-94 97-100 93-95 71-83 97-99 95-97 90-96 97-99 97-99 70-84 98-99 92-95 91-96 97-98 95-98 92-94 |
| Hg | 10 | Ướt: HNO3+HClO4 HNO3+HClO4+H2SO4 HNO3+H2SO4+K2Cr2O7 Khô | Không | 450 550 | 78-80 90-94 92-94 0 0 |
| Zn | 10 | Ướt: HNO3+HClO4 HNO3+HClO4+H2SO4 HNO3+H2SO4 Khô | Không HNO3 H2SO4 Mg(NO3)2 | 550 550 550 550 | 97-100 94-102 96-100 87-96 93-97 97-100 98-99 |
| As | 10 | Ướt: HNO3+HClO4 HNO3+HClO4+H2SO4 HNO3+H2SO4 Khô | Không HNO3 H2SO4 Mg(NO3)2 | 550 550 550 550 | 96-98 97-99 91-98 80-88 80-84 90-96 92-99 |
| Cu | 10 | Ướt: HNO3+HClO4 HNO3+HClO4+H2SO4 HNO3+H2SO4 Khô | Không HNO3 H2SO4 Mg(NO3)2 | 550 550 550 550 | 99-100 99-101 99-100 86-92 94-96 95-97 97-99 |
| Co | 10 | Ướt: HNO3+HClO4 HNO3+HClO4+H2SO4 HNO3+H2SO4 Khô | Không HNO3 H2SO4 Mg(NO3)2 | 550 550 550 550 | 98-100 98-100 97-99 97-99 90-96 96-99 97-100 |
| Cd | 10 | Ướt: HNO3+HClO4 HNO3+HClO4+H2SO4 HNO3+H2SO4 Khô | Không HNO3 H2SO4 Mg(NO3)2 | 550 550 550 550 | 98-100 98-100 97-100 86-94 82-91 93-97 94-97 |
| Sb | 10 | Ướt: HNO3+HClO4 HNO3+HClO4+H2SO4 HNO3+H2SO4 Khô | Không HNO3 H2SO4 Mg(NO3)2 | 550 550 550 550 | 94-98 95-98 97-99 90-94 92-96 94-98 96-97 |
| Cr | 10 | Ướt: HNO3+HClO4 HNO3+HClO4+H2SO4 HNO3+H2SO4 Khô | Không HNO3 H2SO4 Mg(NO3)2 | 550 550 550 550 | 97-100 98-100 98-100 94-98 95-98 97-99 95-98 |
| Fe | 10 | Ướt: HNO3+HClO4 HNO3+HClO4+H2SO4 HNO3+H2SO4 Khô | Không HNO3 H2SO4 Mg(NO3)2 | 550 550 550 550 | 96-100 98-100 97-100 94-98 96-99 97-100 98-100 |
| Au | 10 | Ướt: HNO3+HClO4 HNO3+HClO4+H2SO4 HNO3+H2SO4 Khô | Không HNO3 H2SO4 Mg(NO3)2 | 550 550 550 550 | 95-98 97-99 97-99 93-99 87-98 97-99 97-100 |
Phân loại về sự chiết pha rắn, SPE
| Khối lượng M | Chất mẫu tan | Độ phân cực của chất phân tích | Cơ chế SPE | Pha tĩnh | Dung môi rửa giải chất phân tích | |
| M<1000 | Tan trong dung môi hữu cơ | Phân cực | NPC | Diol (COHCOH) Cyano (CN) Amino (NH2) Amino (NH2/NH) | n-hexane CHCl3 Aceton Methanol | |
| Phân cực trung bình | LSC | Silicagel trung tính | n-hexane CHCl3 Ethylacetate Methanol | |||
| Không phân cực | RPC | Silica-C8 Silica-C18 Silica-phenyl Silica-CN | Nước Methanol Aceton Acetonitril n-hexane | |||
| Ion | Cation | IEC | Silica-SO3H Silica-COOH Silica-RCOOH Silica-NH2 Silica-C6H5SO3H Silica-NH2, -NH Amin tứ cấp | Đệm Phosphate Acetate Amoni Acid loãng Baz loãng | ||
| Anion | IEC | |||||
| Tan trong nước | Không ion | Phân cực | NPC | Silica-diol Silica-CN Silica-NH2 .... | CHCl3 n-hexane Aceton Methanol | |
| Phân cực trung bình | LSC | Silicagel trung tính | Nước Methanol Acetonitril THF... | |||
| Không phân cực | RPC | Silica-C8 Silica-C18 Silica-phenyl Silica-CN | | |||
| Vết ion kim loại | Tan trong nước | | IEC | Silica-SO3H Silica-COOH Silica-C6H5SO3H | Đệm Acid loãng Baz loãng | |
![[Tutorial] Chuyên đề xử lý mẫu phân tích [Tutorial] Chuyên đề xử lý mẫu phân tích](https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgY6LD9nVw4-q0u9o4ME5NqlOmJ98mmX15vWQF0WapzbT3KYhYOgn5K4RRV-z7sSeOUekYDvVcGs97iMoV6I9hZ4sEVItnmKGa1-9JH_rYSx1zKt5k8oGdH2T_NEd6r1mbYGuoknLJ_7wA/s1600/xu+ly+mau+phan+tich_opt.jpg)


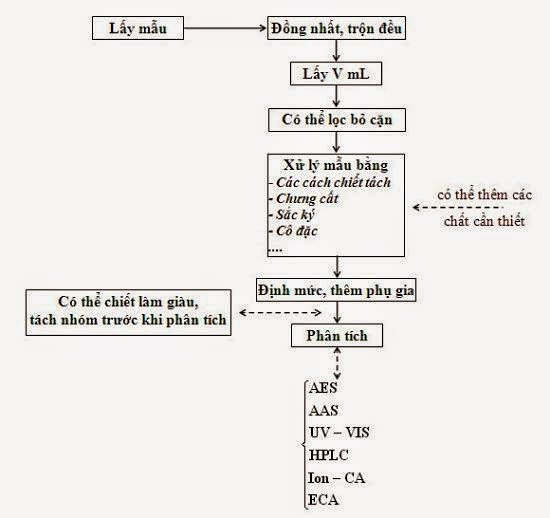


Đăng nhận xét